化学与STSE(社会、科学、技术和环境)密切相关,下列说法正确的是
①寻找合适催化剂提高合成氨工业中原料的转化率
②氟氯烃分解产生的氯原子因能降低臭氧分解的活化能而加速臭氧的分解反应
③氟化物防止龋齿所涉及到的化学原理其实就是沉淀的转化
④煤气中毒或救治与氧气、一氧化碳和血红蛋白结合过程中的化学平衡移动有关
| A.①②③ | B.②③④ | C.①④ | D.③④ |
下列有关平衡常数的说法正确的是
| A.温度越高,K值越大 | B.K值越大,正反应速率越大 |
| C.K值的大小与起始浓度有关 | D.K值越大,反应物的转化率越大 |
某些天然气开采中含有H2S气体,为了安全、有效地利用这一资源,提高经济价值,工业上可以采取多种处理方式。
Ⅰ.吸收:
(1)加工过程中常用氨水吸收H2S,产物为NH4HS,请写出对应的化学方程式: 。
Ⅱ.再利用:加工过程中产生的H2S废气可用来制H2,既廉价又环保。工业上采用以下两种方法制备H2
1高温热分解法
已知:H2S(g) H2(g)+S(g) △H
H2(g)+S(g) △H
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图。请回答:

(2)△H 0(填 “>”或者“<”),你判断的依据是: 。
ii.图中a为H2S的平衡转化率与温度关系曲线,
(3)据图计算985℃时H2S按上述反应分解的平衡常数K=________
2电化学法
已知:该法制氢过程的示意图如右,FeCl3溶液可作为H2S的吸收液。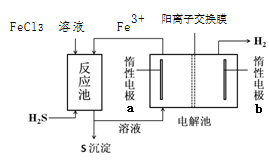
请回答:
(4)反应池中发生反应的离子方程式为_____________。
(5)请结合化学用语解释说明该装置能够产生H2的原因 。
(6)该装置除了能够制氢外,还具有何种优点?请你评价 。
在恒温下的密闭容器中,有可逆反应N2+3H2 2NH3(该反应放热),不能说明已达到平衡状态的是( )
2NH3(该反应放热),不能说明已达到平衡状态的是( )
| A.1molN≡N键断裂的同时,有6molN—H键断裂 |
| B.反应器中压强不随时间变化而变化 |
| C.v正(NH3)= v逆(H2) |
| D.混合气体平均相对分子质量保持不变 |
已知H2(g)+I2(g)  2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
| A.甲中充入HI气体,乙中不变 | B.甲降低温度,乙增大压强 |
| C.甲中加入0.1 mol He,乙中不变 | D.甲增加0.1 mol H2,乙增加0.1 mol I2 |
在相同温度下(T=500 K),有相同体积的甲、乙两容器,且保持体积不变,甲容器中充入1 g SO2和1gO2,乙容器中充入2 g SO2和2 g O2。下列叙述中错误的是( )
| A.平衡时SO2的体积分数:乙>甲 | B.平衡时O2的浓度:乙>甲 |
| C.平衡时SO2的转化率:乙>甲 | D.化学反应速率:乙>甲 |
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
A.反应CO(g)+H2O(g) CO2(g)+H2(g)的ΔH>0 CO2(g)+H2(g)的ΔH>0 |
| B.在T2时,若反应处于状态D,则一定有ν正<ν逆 |
| C.平衡状态A与C相比,平衡状态A的c(CO)小 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
在一定温度下,硫酸铜晶体的培养皿中存在下列平衡:Cu2+ +SO42-+x H2O CuSO4·xH2O,当向溶液中加少量无水硫酸铜粉末后,下列说法中正确的是
CuSO4·xH2O,当向溶液中加少量无水硫酸铜粉末后,下列说法中正确的是
| A.溶液中Cu2+浓度增大 | B.溶液中Cu2+数目增大 |
| C.该硫酸铜晶体体积不变 | D.溶液的蓝色不变 |
在体积不变的密闭容器中按一定比例通入氮气和氢气,反应合成氨气,该反应放热。欲加快反应的速率同时提高合成氨中H2的转化率,下列措施可行的是( )
| A.升高温度 | B.适当增大压强 | C.加入催化剂 | D.从容器中分离出氨 |
可逆反应CO(g)+H2O(g) CO2(g)+H2(g),达到平衡后,有关化学反应限度的说法正确的是
CO2(g)+H2(g),达到平衡后,有关化学反应限度的说法正确的是
| A.V正=0 | B.V逆=0 | C.V正=V逆≠0 | D.V正=V逆=0 |
吸热反应N2(g)+O2(g) 2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
通过计算回答:
(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行以达到化学平衡状态?
t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g).2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g).2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)从反应开始至达到平衡状态,生成C的平均反应速率为 .
(2)x= ;平衡常数K= .
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) .
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 .
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是(用离子方程式表示) 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,
c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
□ClO3―+□Fe2++□ =□Cl―+□Fe3++□ 。
(3)生成聚合氧化铁的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
试题篮
()