已知反应2CH3OH(g) CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
下列说法正确的是
A.a = 1.64
B.此时刻正反应速率大于逆反应速率
C.若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大
D.若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
下列有关说法错误的是
| A.NH3(g)+HC1(g)=NH4C1(S)低温下能自发进行,说明该反应的△H<O |
| B.为保护海轮的船壳,常在船壳上镶入锌块 |
| C.纯碱溶于热水中,去污效果增强,说明纯碱的水解是吸热反应 |
| D.反应N2(g)+3H2(g)(△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动。 |
本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
| A.化学反应速率理论是研究怎样在一定时间内快出产品 |
| B.化学平衡理论是研究怎样使用有限原料多出产品 |
| C.化学反应速率理论是研究怎样提高原料转化率 |
| D.化学平衡理论是研究怎样使原料尽可能多地转化为产品 |
在可逆反应:X(g)+2Y(g) 2Z(g)(△H>0),为了有利于Z的生成,应采用的反应条件是( )
2Z(g)(△H>0),为了有利于Z的生成,应采用的反应条件是( )
| A.高温高压 | B.高温低压 | C.低温高压 | D.低温低压 |
下列叙述中,不能用平衡移动原理解释的是
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| D.黄绿色的氯水光照后颜色变浅 |
把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:
3A(气)+B(气) 2C(气)+。X D(气)经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/L•min,下列说法中错误的是 ( )
2C(气)+。X D(气)经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/L•min,下列说法中错误的是 ( )
| A.x = 2 |
| B.B的转化率为20% |
| C.平衡时A的浓度为0.75mol/L |
| D.恒温达平衡时容器内压强为开始时的85% |
在一密闭容器中,反应xA(g) +yB(g)  zC(其中x、y、z为化学计量数)达平衡后,平衡时测得A的浓度为0.5mol/L。保持温度不变,将容器容积扩大为原来的两倍,再达到平衡时,测得A的浓 度0.3mol/L。则下列叙述不正确的是
zC(其中x、y、z为化学计量数)达平衡后,平衡时测得A的浓度为0.5mol/L。保持温度不变,将容器容积扩大为原来的两倍,再达到平衡时,测得A的浓 度0.3mol/L。则下列叙述不正确的是
| A.x+y>z | B.平衡向正反应方向移动 |
| C.B转化率减小 | D.C的体积分数下降 |
吸热反应N2(g)+O2(g) 2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
通过计算回答:
(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行以达到化学平衡状态?
t℃时,将3molA和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g).2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g).2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)从反应开始至达到平衡状态,生成C的平均反应速率为 .
(2)x= ;平衡常数K= .
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) .
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 .
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是(用离子方程式表示) 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,
c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
□ClO3―+□Fe2++□ =□Cl―+□Fe3++□ 。
(3)生成聚合氧化铁的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
一定温度下,在容积为1L的密闭容器中,存在如下关系:xH2O(g)  (H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是
(H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是
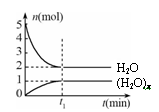
| A.x=3 |
| B.该温度下,反应的平衡常数为0.125 L2/mol2 |
| C.平衡时混合气体的平均摩尔质量是30 |
| D.t1时刻,保持温度不变,再充入1 molH2O(g), |
重新达到平衡时,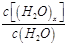
 将增大
将增大
25℃时,水的电离达到平衡:H2O H++OH―;ΔH>0,下列叙述正确的是
H++OH―;ΔH>0,下列叙述正确的是
| A.向水中加人稀氨水,平衡逆向移动,c(OH―)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加人少量固体NaCl,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
在一定温度下,反应A2(g)+B2(g)  2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
| A.单位时间内生成n mol A2,同时生成n mol AB |
| B.容器内总压强不随时间改变 |
| C.任何时间内A2、B2的物质的量之比为定值 |
| D.单位时间内生成2n mol AB同时生成n mol B2 |
试题篮
()