一个恒容容器中盛有1molNO2,发生反应:2NO2(g) N2O4(g),反应达到平衡时,混合气体中NO2所占体积分数为M%。保持温度不变,再投入1molNO2,达到平衡时,混合气体中NO2所占体积分数为N%。则M和N的关系是
N2O4(g),反应达到平衡时,混合气体中NO2所占体积分数为M%。保持温度不变,再投入1molNO2,达到平衡时,混合气体中NO2所占体积分数为N%。则M和N的关系是
| A.M>N | B.M<N | C.M=N | D.不能确定 |
一定温度下,向aL体积固定的密闭容器中加入2molN2(g)、1moH2(g),发生如下反应:N2(g)+3H2(g) 3NH3(g),此反应达到平衡状态的标志是
3NH3(g),此反应达到平衡状态的标志是
| A.相同时间内消耗n mol N2的同时消耗3n mol H2 |
| B.H2的体积分数不再发生变化 |
| C.容器内原子总数不再发生变化 |
| D.容器内气体的密度不再发生变化 |
在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应: 2NO(g)+C(g) N2(g)+CO2(g)△H="-213.5kJ" mol-1,达到平衡时的数据如下:
N2(g)+CO2(g)△H="-213.5kJ" mol-1,达到平衡时的数据如下:
| 温度/℃ |
n(活性炭)/mol |
n(CO2)/mol |
| T1 |
0.70 |
|
| T2 |
|
0.25 |
下列说法不正确的是
A.上述信息可推知:T1<T2
B.T1℃时,该反应的平衡常数K=9/16
C.T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减
D.T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
下列说法正确的是
| A.含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 |
B.500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中反应生成NH3(g),反应达到平衡时放出的热量为7.72kJ,其热化学方程式为: △H=-38.6kJ·mol-1 △H=-38.6kJ·mol-1 |
C.对于可逆反应 △H﹤0,升高温度,可使反应速率增大,反应逆向移动 △H﹤0,升高温度,可使反应速率增大,反应逆向移动 |
| D.元素原子的最外层电子数的多少与其非金属性的强弱无必然联系。 |
现有可逆反应2NO2(g) N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措(只改变一种外部条件)。
N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措(只改变一种外部条件)。

t2: ;t3: ;t4: 。
已知:A(g) + 2B(g)  2C(g) ΔH < 0。此反应的平衡常数表达式K=__________,温度降低,
2C(g) ΔH < 0。此反应的平衡常数表达式K=__________,温度降低,
K值会______(增大、减小、不变),A的转化率 ,化学反应速率 .。
已知一定温度下,X(g)+2Y(g) mZ(g);△H=-akJ/mol(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达到平衡状态时,放出热量ckJ,且2b<c,则下列各值关系正确的是( )
mZ(g);△H=-akJ/mol(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达到平衡状态时,放出热量ckJ,且2b<c,则下列各值关系正确的是( )
| A.a="b" | B.2a<c | C.m>3 | D.m<3 |
在一密闭容器中,反应aA(g)  bB(g),达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡后,B的浓度是原平衡的60%,则( )
bB(g),达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡后,B的浓度是原平衡的60%,则( )
| A.平衡向正反应方向移动了 | B.物质A的转化率减少了 |
| C.物质B的质量分数减小了 | D.a > b |
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s)ΔH>0,下列叙述正确的是( )
Z(g)+W(s)ΔH>0,下列叙述正确的是( )
| A.加入少量W,逆反应速率增大 |
| B.升高温度,正反应速率增大,逆反应速率减小,平衡正向移动。 |
| C.当容器中气体压强不变时,反应达到平衡 |
| D.平衡后加入X,上述反应的ΔH增大 |
对可逆反应4NH3(g)+5O2(g)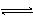 4NO(g)+6H2O(g),下列叙述正确的是()
4NO(g)+6H2O(g),下列叙述正确的是()
| A.化学反应速率关系是:2v正(NH3)=3v正(H2O) |
| B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D.达到化学平衡时,4v正(O2)=5v逆(NO) |
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)⇌SO3(g)+NO(g)达到平衡,正反应速率随时间变化的如上图所示.由图可得出的正确结论是( )

| A.反应物的总能量低于生成物的总能量 |
| B.反应物浓度:a点小于b点 |
| C.△t1=△t2时,SO2的转化率:a~b段小于b~c段 |
| D.反应在c点达到平衡状态 |
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌xC(g)+2D(s).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol/L.下列判断正确的是( )
| A.该条件下此反应的化学平衡常数约为0.91 |
| B.A的平均反应速率为0.3mol/(L•s) |
| C.B的转化率为60% |
| D.若混合气体的密度不再改变时,该反应不一定达到平衡状态 |
某温度下,将3molA和3molB充入体积为 1L的密闭容器中,发生如下反应:aA(g)+2B(g)⇌3C(g)+D(g).反应达到平衡后,C的浓度为 3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为( )
| A.1 | B.2 | C.3 | D.4 |
两个极易导热的密闭容器A和B,容器A容积恒定,容器B容积可变,在温度、压强和起始体积相同的条件下往A和B中分别充入等物质的量的NO2,发生反应2NO2⇌N2O4△H<0,以下说法正确的是( )
A. 反应起始时,两容器中的反应速率关系是v(A)<v(B)
B. 反应过程中,两容器内的反应速率关系为v(A)<v(B)
C. 两容器内的反应达到平衡所需时间一定相同
D. 反应达到平衡时,两容器内的压强关系是p(A)>p(B)
下列事实不能用勒夏特列原理解释的是( )
| A.向饱和NaCl溶液中1:1通入NH3和CO2制备NaHCO3 |
| B.500℃左右比常况下更有利于合成氨 |
| C.实验室中常用排饱和食盐水的方法收集氯气 |
| D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
试题篮
()