某温度下,某反应达平衡时平衡常数K= 。恒容时,温度升高,H2的浓度减小。下列说法正确的是
。恒容时,温度升高,H2的浓度减小。下列说法正确的是
| A.恒温恒容下,增大压强,H2的浓度一定减小 |
| B.该反应的焓变为正值 |
| C.升高温度,逆反应速率减小 |
D.该反应的化学方程式为CO+H2O CO2+H2 CO2+H2 |
300℃下,将2 mol SO2 1 mol O2混合于2 L的恒容密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH,2分钟末达到平衡,测得SO2的转化率为60%。请根据化学反应的有关原理回答下列问题:
2SO3(g) ΔH,2分钟末达到平衡,测得SO2的转化率为60%。请根据化学反应的有关原理回答下列问题:
(1)能证明反应已经达到平衡状态的是
①c(SO2):c(O2):c(SO3)=2:1:2
②单位时间内生成nmol SO3的同时消耗nmol SO2
③反应速率2v(SO3)= v(O2)
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(2)如图表示该反应的速率(v)随时间(t)的变化的关系:
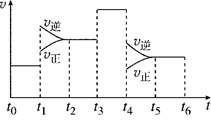
据图分析:你认为t3时改变的外界条件可能是________;t6时保持体积不变向体系中充入少量He气,平衡 移动。(填“向左”“向右”或“不”)。SO2%含量最高的区间是
(t0~t1,t2~t3,t3~t4,t5~t6)。
(3)300℃时,该反应的平衡常数为 ,若升高温度该反应的平衡常数减小,则ΔH 0(填“大于”小于“或“不确定”)
(4)如果在相同条件下,上述反应从逆反应方向进行,开始时加入SO20.6 mol加入SO31.4 mol,若使平衡时各物质的量浓度与原来平衡相同,则还应加入O2 mol。
一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
| A.以X浓度变化表示的反应速率为0.001 mol/(L·s) |
| B.将容器体积变为20 L,Z的平衡浓度变为原来的 |
| C.其他条件不变时,若增大压强,则物质Y的转化率减小 |
| D.其他条件不变时,若升高温度,X的体积分数增大,则该反应的ΔH>0 |
在一定温度下,容积一定的密闭容器中发生反应A(s)+2B(g) C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
①混合气体的密度②混合气体的压强③B的物质的量浓度④混合气体的总物质的量
| A.①② | B.①③ | C.②③ | D.①④ |
某温度下,将2 mol A和1 mol B放入一密闭容器中,发生反应:A(g)+B(g) 2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
A.该反应的化学平衡常数表达式是K=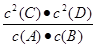 |
| B.该条件下B的平衡转化率是40% |
| C.增大该体系的压强,A的转化率增大 |
| D.若向平衡体系中加入少量生成物C,则正、逆反应速率均增大 |
在一个容积为2L的密闭容器中,加入0.8molA2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+ B2(g)====2AB(g)ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说明不正确的是 ( )

| A.图中a点的值为0.15 |
| B.该反应的平衡常数K=0.03 |
| C.温度升高,平衡常数K值减小 |
| D.平衡时A2的转化率为62.5% |
化学理论在元素单质及其化合物反应中应用广泛。
(1)在一定条件下,可逆反应mA nB+pC△H,达到平衡状态。
nB+pC△H,达到平衡状态。
①若A、B、C都是气体,增大压强,平衡向正反应方向移动,则m n+p(填“大于”、“小于”或“等于”)。
②其他条件不变,加热后A的质量减小,则反应△H 0(填“大于”、“小于”或“等于”)。
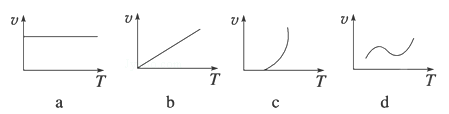
(2)某些金属氧化物(如FeXOY)粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是 (填序号)。
(3)一定温度下,发生反应:FeO(s)+CO(g) Fe(s)+CO2(g) △H。已知该反应在不同温度下的平衡常数如下表:
Fe(s)+CO2(g) △H。已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ |
1000 |
1100 |
| 平衡常数 |
0.68 |
0.50 |
请回答下列问题:
①该反应的△H 0(填“>”、“<”或“=”)。
②T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为W1,c(CO2)=0.15mol•L﹣1,则温度T (填“高于”、“低于”、“等于”)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为W2,则W1 W2(填“>”、“<”或“=”)。
在一密闭容器中发生反应N2+3H2 2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:

(1)处于平衡状态的时间段是 (填选项)。
A.t0~t1
B.t1~t2
C.t2~t3
D.t3~t4
E.t4~t5
F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是_____(填选项)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.加催化剂
F.充入氮气
t1时刻 ;t3时刻 ;t4时刻 。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 (填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 。
可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①一个N≡N键断裂的同时,有6个N﹣H键断裂
②v(H2)=0.6mol•L﹣1•min﹣1,v(NH3)=0.4mol•L﹣1•min﹣1
③保持其他条件不变时,体系压强不再改变;
④NH3、N2、H2的体积分数都不再改变;
⑤恒温恒容时,混合气体质量保持不变。
| A.②③④ | B.①②④ | C.①③④ | D.③④⑤ |
已知反应2A(g)=2B(g)+C(g)△H<0,达平衡时,要使c(A)增大同时使v(正)增大,应改变的条件为( )
A.减小容器容积 B.增大容器容积 C.减小B的浓度 D.降温
有一处于平衡状态的反应A(g) + 3B(g) 2C(g);△H< 0,为了使平衡向生成C的方向移动,应选择的条件是( )
2C(g);△H< 0,为了使平衡向生成C的方向移动,应选择的条件是( )
| A.高温低压 | B.低温低压 | C.低温高压 | D.高温高压 |
可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①一个N≡N键断裂的同时,有6个N﹣H键断裂
②v(H2)=0.6mol•L﹣1•min﹣1,v(NH3)=0.4mol•L﹣1•min﹣1
③保持其他条件不变时,体系压强不再改变;
④NH3、N2、H2的体积分数都不再改变;
⑤恒温恒容时,混合气体质量保持不变。
| A.②③④ | B.①②④ | C.①③④ | D.③④⑤ |
试题篮
()