下列事实,不能用勒夏特列原理解释的是
A.溴水中有平衡:Br2+ H2O  HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 |
B.对CO(g) + NO2 (g)  CO2(g)+ NO(g) 平衡体系增大压强可使颜色变深 CO2(g)+ NO(g) 平衡体系增大压强可使颜色变深 |
| C.升高温度能够增大硝酸钾在水中的溶解度 |
| D.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
已知2SO2(g)+ O2(g) 2SO3(g) △H<0,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2,2min反应达平衡时,容器中有1.2 mol SO3,放出热量118.2kJ,试计算:
2SO3(g) △H<0,温度一定,体积为3L的密闭容器中,投入2 mol SO2和1 molO2,2min反应达平衡时,容器中有1.2 mol SO3,放出热量118.2kJ,试计算:
(要求写计算过程)
(1)写出该反应的热化学方程式。
(2)该反应中SO2的转化率是多少?
(3)反应2分钟,以O2表示的平均反应速率为多少?
(4)计算达平衡后SO2的质量分数为多少?
加热N2O5时,发生以下两个分解反应:N2O5 N2O3+O2,N2O3
N2O3+O2,N2O3 N2O+O2,在1 L密闭容器中加热4 mol N2O5达到化学平衡时c(O2)为4.50 mol/L,c(N2O3)为1.62 mol/L,则在该温度下各物质的平衡浓度正确的是
N2O+O2,在1 L密闭容器中加热4 mol N2O5达到化学平衡时c(O2)为4.50 mol/L,c(N2O3)为1.62 mol/L,则在该温度下各物质的平衡浓度正确的是
| A.c(N2O5)=1.44 mol/L | B.c(N2O5)=0.94 mol/L |
| C.c(N2O)=1.40 mol/L | D.c(N2O)=3.48 mol/L |
X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:
X+2Y 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于
| A.66% | B.60% | C.50% | D.33% |
㈠已知:2H2 ( g ) + O2 ( g ) = 2H2O ( l ); △H = -571.6kJ/mol
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ); △H = -890 kJ/mol
标准状况下,取甲烷和氢气的混合气体11.2 L完全燃烧后恢复到常温,则放出的热量为203.32kJ,试求混合气体中甲烷和氢气体积比。
(二)在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3mol气体N混合,发生如下反应:2M(g)+ 3N(g) Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
(1)用气体M来表示该反应的化学反应速率是多少?
(2)反应前后的压强比?
(3)N的转化率是多少?
(4)平衡时气体Q所占的体积分数为多少?
某温度时反应C(S)+2H2  CH4的K=8.28,当各气体物质的量浓度分别为H2 0.7 mol/l、CH4 0.2mol/l 时,上述反应
CH4的K=8.28,当各气体物质的量浓度分别为H2 0.7 mol/l、CH4 0.2mol/l 时,上述反应
| A.正向移动 | B.逆向移动 | C.达到平衡 | D.不一定 |
可逆反应2SO2(g)+O2(g) 2SO3(g) ;△H<0, 在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图所示。
2SO3(g) ;△H<0, 在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图所示。
下列说法正确的是
| A.维持温度、反应体系容积不变,t1时充入SO3(g) |
| B.维持压强不变,t1时升高反应体系温度 |
| C.维持温度、容积不变,t1时充入一定量Ar |
| D.维持温度、压强不变,t1时充入SO3(g) |
在容积为1 L的密闭容器中,进行如下反应:
A(g)+2B(g)  C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。

请回答下列问题:
(1) 700℃时,0~5min内,以B表示的平均反应速率为___________。
(2) 能判断反应达到化学平衡状态的依据是__________。
A.容器中压强不变 B.混合气体中c(A)不变
C.v正(B)=2v逆(D) D.c(A)=c(C)
(3) 若最初加入1.0 mol A和2.2 mol B,利用图中数据计算在800℃时的平衡常数K=__________,该反应为__________反应(填“吸热”或“放热”)。
(4) 800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,则此时该反应__________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
在温度相同,压强分别为P1和P2的条件下,A(g)+2B(g)  nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是
nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是
| A.P1>P2,n<3 | B.P1<P2,n>3 |
| C.P1>P2,n>3 | D.P1<P2,n<3 |
80 ℃时,2 L 密闭容器中充入0.40 mol N2O4,发生反应N2O4 2NO2 ΔH=+Q kJ·mol-1(Q>0),获得如下数据:
2NO2 ΔH=+Q kJ·mol-1(Q>0),获得如下数据:
| 时间/s |
0 |
20 |
40 |
60 |
80 |
100 |
| c(NO2)/mol·L-1 |
0.00 |
0.12 |
0.20 |
0.26 |
0.30 |
0.30 |
下列判断正确的是( )
A.升高温度该反应的平衡常数K减小
B.20~40 s 内,v(N2O4)=0.004 mol·L-1·s1
C.反应达平衡时,吸收的热量为0.30 Q kJ
D.100 s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大
利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)  5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4 molCO,测得CO2的体积分数随时间t变化曲线如图。请回答:
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4 molCO,测得CO2的体积分数随时间t变化曲线如图。请回答:
(1)T2时,0~0.5min内的反应速率v(CO)=___________。
(2)T1时化学平衡常数K=______________。
(3)下列说法不正确的是_______(填字母序号)。
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,C点时体系中混合气体的压强相等 |
| C.d点时,增大体系压强,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb<Kd |
对于A+2B(气) nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增减,平衡不移动,则A为______态(填“气”或“非气”)。
(2)增压,平衡不移动,当n=2时,A的状态为________态;(填“气”或“非气”)
当n=3时,A的状态为______态。(填“气”或“非气”)
(3)若A为固体,增大压强,C的组分含量减少,则n____2(填>、=、<)
(4)升温,平衡向右移动,则该反应为________反应(填吸热或放热)。
一定条件下反应2AB(g)  A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
有一化学平衡:mA(g)+nB(g) pC(g)+qD(g)(如右图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是
pC(g)+qD(g)(如右图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是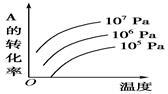
| A.正反应吸热:m+n>p+q |
| B.正反应吸热:m+n<p+q |
| C.正反应放热:m+n>p+q |
| D.正反应放热:m+n<p+q |
试题篮
()