在一个活塞式的反应容器中,通入2molSO2和1molO2,于500℃下发生化合反应并达到平衡,在保持恒温、恒压的条件下,再通入2molSO2和1molO2,第二次刚通入后反应速率的变化及最终SO3的含量的有关叙述正确的是
| A.V正增大,V逆减小,SO3的百分含量增加 |
| B.V正增大,V逆不变,SO3的百分含量不变 |
| C.V正增大,V逆增大,SO3的百分含量无法判断 |
| D.V正增大,V逆减小,SO3的百分含量保持不变 |
反应NH4HS(s) NH3(g)+H2S(g)在一定温度下达到平衡。下列各种情况下,不能使平衡发生移动的是( )
NH3(g)+H2S(g)在一定温度下达到平衡。下列各种情况下,不能使平衡发生移动的是( )
| A.温度、容积不变时,通入SO2气体 | B.移走一部分NH4HS固体 |
| C.容积不变,充入氮气 | D.充入氮气,保持压强不变 |
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应:
A(s)+2B(g) C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
| A.混合气体的压强 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.气体的总物质的量 |
对于反应2SO2+O2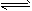 2SO3,下列判断正确的是
2SO3,下列判断正确的是
| A.2体积2SO2和足量O2反应,必定生成2体积SO3 |
| B.其他条件不变,增大压强,平衡必定向右移动 |
| C.平衡时,SO2消耗速度必定等于O2生成速度的两倍 |
| D.平衡时,SO2浓度必定等于O2浓度的两倍 |
对于反应2X(g)+Y(g) 2Z(g)不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)和反应时间t的关系如下图所示,下列判断正确的是( )
2Z(g)不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)和反应时间t的关系如下图所示,下列判断正确的是( ) 
| A.T1<T2,p1<p2,正反应为放热反应 |
| B.T1<T2,p1>p2,正反应为吸热反应 |
| C.T1>T2,p1>p2,正反应为放热反应 |
| D.T1>T2,p1<p2,正反应为吸热反应 |
在2NO2 N2O4的可逆反应中,下列状态属平衡状态的是
N2O4的可逆反应中,下列状态属平衡状态的是
| A.混合物中,NO2的百分含量不再改变的状态 |
| B.NO2的分子数与N2O4分子数的比值为2∶1的状态 |
| C.体系的颜色不再发生变化的状态 |
| D.NO2全部转变成N2O4的状态 |
下列叙述可用于说明H2+I2 2HI已达到平衡状态的是
2HI已达到平衡状态的是
| A.一个H-H键断裂的同时有一个I-I键组成 |
| B.一个H-H键断裂的同时有一个I-I键断裂 |
| C.一个H-I键形成的同时有一个H-H键断裂 |
| D.一个H-I键断裂的同时有一个H-H键形成 |
在密闭容器中,下列反应已达平衡:aA(气)+bB(气) cC(气)+dD(气)+Q如果升高温度或降低压强,则C(气)的物质的量都增大,试判断下列各组关系,哪组是正确的
cC(气)+dD(气)+Q如果升高温度或降低压强,则C(气)的物质的量都增大,试判断下列各组关系,哪组是正确的

在图中x%为气态反应物在平衡体系中的质量分数,该图表示x%、同温度、压强的关系,符合曲线反应的是
A.2NH3(气) N2(气)+3H2-Q N2(气)+3H2-Q |
B.H2(气)+I2(气) 2HI(气)+Q 2HI(气)+Q |
C.4NH3(气)+3O2(气) 2N2(气)+6H2O(气)+Q 2N2(气)+6H2O(气)+Q |
D.C(固)+H2O(气) H2(气)+CO(气)-Q H2(气)+CO(气)-Q |
在相同条件下(T=500℃),相同体积的甲、乙两容器,甲容器充入1gSO2和1gO2,乙容器充入2gSO2和2gO2。下列叙述中错误的是
| A.化学反应速度乙>甲 |
| B.平衡后O2的浓度乙>甲 |
| C.SO2的转化率乙>甲 |
| D.平衡后O2的体积百分含量乙>甲 |
在某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:
aA(气)+B(气) C(气)+D(气)
C(气)+D(气)
5 min后达到平衡。已知各物质的平衡浓度的关系为:
[A]a[B]=[C][D]</PGN0039A.TXT/PGN>
若在温度不变的情况下将容器的体积扩大为原来的10倍,其A的转化率不发生变化,则B的转化率为
A.60%
B.40%
C.24%
D.4%
在373K时,把0.5molN2O4气通入体积为5L的真空密闭容器中,立即出现棕色。反应进行到2s时,NO2的浓度为0.02 mol/L。在60s时,体系已达平衡,此时容器内压强为开始时的 1.6倍。下列说法正确的是
| A.前2s,以N2O4浓度变化表示的平均反应速率为0.01 mol/(L·s) |
| B.在2s时体系内的压强为开始时的1.1倍 |
| C.在平衡时体系内含N2O40.25 mol |
| D.平衡时,如果压缩容器体积,则可提高N2O4的转化率 |
在一定条件下,将1 mol CO和1 mol水蒸气混合后发生如下反应:
CO(气)+H2O(气) CO2(气)+H2(气)若反应达到平衡时测得CO的转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的
CO2(气)+H2(气)若反应达到平衡时测得CO的转化率为21.75%,则平衡混合气体的密度为相同条件下H2密度的
| A.5.75倍 |
| B.11.5倍 |
| C.30.67倍 |
| D.46倍 |
试题篮
()