在一定条件下,x A (g)+y B (g) z C(g)的反应达到平衡。
z C(g)的反应达到平衡。
⑴已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z间的关系
是_________________________。
⑵已知C是气体,如果反应中x+y=z在增大压强时其平衡发生移动,则一定向
_____ __移动。
⑶已知C是气体,当其他条件不变,增大 A的物质的量时平衡不移动,则A是 态。
⑷加热后C的质量分数减小,则正反应是_________(填“放热”或“吸热”)反应。
已知真空炼铷的原理如下:2RbCl+Mg MgCl2+2Rb(g)。对于此反应的进行能给予正确解释的是( )。
MgCl2+2Rb(g)。对于此反应的进行能给予正确解释的是( )。
| A.铷的金属活动性不如镁强,镁可置换出铷 |
| B.铷的沸点比镁低,把铷蒸气抽出时,平衡向右移 |
| C.铷的单质状态较化合态更稳定 |
| D.MgCl2的热稳定性不如RbCl强 |
下列平衡体系中,升温或减压都使平衡向右移动的是 ( )
A.N2(g)+3H2(g)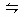 2NH3(g);ΔH<0 2NH3(g);ΔH<0 |
B.N2(g)+O2(g)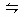 2NO(g);ΔH<0 2NO(g);ΔH<0 |
C.C(s)+H2O(g)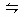 CO(g)+H2(g);ΔH>0 CO(g)+H2(g);ΔH>0 |
D.2SO2(g)+O2(g)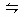 2SO3(g);ΔH<0 2SO3(g);ΔH<0 |
在已处于化学平衡状态的体系中,如果下列量发生变化,其中一定表明平衡发生移动的量是 ( )
| A.反应混合物的浓度 | B.反应物的转化率 |
| C.正、逆反应速率 | D.体系的压强 |
一定温度时于密封容器中发生反应:m A (g)+n B (g)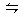 p C(g),达到平衡后,若将气体体积压缩到原来的一半,当再达平衡时C的溶液是原来的1.9倍,则下列叙述正确的是 ( )
p C(g),达到平衡后,若将气体体积压缩到原来的一半,当再达平衡时C的溶液是原来的1.9倍,则下列叙述正确的是 ( )
| A.平衡向正反应方向移动 | B.C气体的质量分数增大 |
| C.气体A的转化率降低 | D.m+n>p |
氙和氟单质按一定比例混合,在一定条件下反应达到如下平衡:Xe(g)+2F2(g)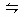 XeF4(g) △H<0,下列措施中既能加快反应速率,又能使平衡向正反应方向移动的是( )
XeF4(g) △H<0,下列措施中既能加快反应速率,又能使平衡向正反应方向移动的是( )
| A.升温 | B.加压 | C.减压 | D.降温 |
在一烧瓶中,在25℃时存在着平衡:2NO2 N2O4;ΔH<0。把烧瓶置于100℃的水中,则下列几项性质①颜色;②平均相对分子质量;③质量;④压强;⑤密度。不会改变的是 ( )
N2O4;ΔH<0。把烧瓶置于100℃的水中,则下列几项性质①颜色;②平均相对分子质量;③质量;④压强;⑤密度。不会改变的是 ( )
| A.①和③ | B.②和④ | C.④和⑤ | D.③和⑤ |
对于m A (g)+n B (g) p C(g)+q D(g)的平衡体系,当升高温度时,平衡混合气体对氢气的相对密度从16.5变成16.9,则下列说法正确的是 ( )
p C(g)+q D(g)的平衡体系,当升高温度时,平衡混合气体对氢气的相对密度从16.5变成16.9,则下列说法正确的是 ( )
| A.m+n> p+q,正反应是放热反应 |
| B.m+n> p+q,正反应是吸热反应 |
| C.m+n< p+q,逆反应是放热反应 |
| D.m+n< p+q,逆反应是吸热反应 |
有一处平衡状态的反应X(s)+3Y(g) 2Z(g)△H<0。为了使平衡向生成Z的方向移动,应采取的措施是( )
2Z(g)△H<0。为了使平衡向生成Z的方向移动,应采取的措施是( )
①升高温度;②降低温度;③增大压强;④减小压强;⑤加入催化剂;⑥及时分离出Z。
| A.①③⑤ | B.②③⑤ | C.②③⑥ | D.②④⑥ |
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数Kc |
9.94 |
9 |
1 |
试回答下列问题
(1)上述正向反应是: ▲ 反应(选填:放热、吸热)。
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 ▲ (选填A、B、C、D、E)。
| |
A |
B |
C |
D |
E |
| n(CO2) |
3 |
1 |
0 |
1 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
2 |
| n(CO) |
1 |
2 |
3 |
0.5 |
3 |
| n(H2O) |
5 |
2 |
3 |
2 |
1 |
(3)已知在一定温度下:C(s)+CO2(g)  2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g)  CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,
则K、K1、K2之间的关系是: ▲ 。
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020 mol/L,在该条件下,CO的最大转化率为: ▲ 。
(5)若在800℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y= ▲ 。
(6)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K= ▲ 。
在5 L的密闭容器中充入2 mol A气体和1 mol B气体,在一定条件下发生反应:2A(g)+B(g) 2C(g),达平衡时,在相同温度下测得容器内混合气体的压强是反应前的
2C(g),达平衡时,在相同温度下测得容器内混合气体的压强是反应前的 ,则A的转化率为
,则A的转化率为
| A.67% | B.50% | C.25% | D.5% |
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 |
⑵在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为:________________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:______________________________________________。
(1)为防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使含硫化合物进入大气)反应的化学方程式:_________________________________ 。
(2)近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式:NH3+HClO H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是 。
H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是 。
试题篮
()