已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O HCl+HClO达到平衡后,要使HClO浓度增大,H浓度减小,可加入
HCl+HClO达到平衡后,要使HClO浓度增大,H浓度减小,可加入
| A.Na2SO3固体 | B.水 | C.CaCO3固体 | D.NaOH固体 |
在一固体体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+Br2(g) 2HBr(g)。已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr。在相同条件下,起始时加入H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,则以下推断不正确的是
2HBr(g)。已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr。在相同条件下,起始时加入H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,则以下推断不正确的是
| A.达平衡时HBr物质的量可能仍为a mol |
| B.x、y、z应满足的关系是4x+z=2y |
| C.达平衡时HBr的物质的量为(x+y+z)a/3 |
| D.x、y、z一定满足关系y=2x |
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
| A.m=2 | B.两次平衡的平衡常数相同 |
| C.X与Y的平衡转化率之比为1:1 | D.第二次平衡时,Z的浓度为0.4 mol·L-1 |
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2 Si3N4+6CO。下列叙述不正确的是
Si3N4+6CO。下列叙述不正确的是
| A.若已知上述反应为放热反应,升高温度,其平衡常数减小 |
| B.上述反应中每生成1molSi3N4,转移12mol电子 |
| C.在氮化硅的合成反应中,N2是氧化剂,SiO2是还原剂 |
| D.若使压强增大,上述平衡向逆反应方向移动 |
一定条件下的可逆反应:X(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断不合理的是
| A.c1:c2=1:3 |
| B.平衡时,Y和Z的生成速率之比为3:2 |
| C.X、Y的转化率不相等 |
| D.c1的取值范围为0< c1<0.14mol/L |
在一密闭容器中,mA(g)+bB(g)⇌pC(g)反应平衡时,测得 c(A)为 0.5mol•L‾1,在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得 c(A)为 0.3mol•L‾1,则下列判断中正确的是
A.平衡向正反应方向移动 B.物质C的质量分数增加
C.化学计量数:m+b<p D.物质B的转化率减小
在2 L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
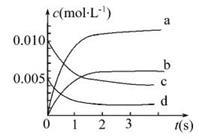
(1)上述反应在第5 s时,NO的转化率为 。
(2)如图中表示NO2变化曲线的是 。用O2表示0~2 s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)="2v" (O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:PbO2 + Pb + 2H2SO4 = 2PbSO4 ↓ + 2H2O,据此判断工作时正极反应为______________。
(5)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量无污染物质并放出大量热。反应的化学方程式为 。
(普通班做)现有反应:CO(g)+ H2O(g) CO2(g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1,现在850℃下,向2L的密闭容器中充入CO、H2O(g)各4mol,回答下列问题:
CO2(g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1,现在850℃下,向2L的密闭容器中充入CO、H2O(g)各4mol,回答下列问题:
(1)当CO转化率为25%时,该反应是否达平衡,向哪个方向进行?
(2)达平衡时,CO转化率为多少?
(3)平衡时,H2的体积分数为多少?
(4)平衡时,混合气体的平均相对分子质量为多少?
(实验班做)现有反应:CO(g)+ H2O(g) CO2(g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1,现在850℃下,向2L的密闭容器中充入CO、H2O(g)各4mol,回答下列问题:
CO2(g)+ H2(g) △H﹤0,在850℃时,平衡常数K=1,现在850℃下,向2L的密闭容器中充入CO、H2O(g)各4mol,回答下列问题:
(1)当CO转化率为25%时,该反应是否达平衡,向哪个方向进行?
(2)达平衡时,CO转化率为多少?
(3)H2的体积分数为多少?
(4)若温度仍为850℃,初始时CO浓度为2mol/L,H2O(g)为6mol/L,则平衡时CO转化率为多少?
(普通班做)在2L恒容密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式: ,已知K(300℃)>K(350℃),则该反应正反应为 反应(填“放热”或“吸热”),升高温度,正反应速率 ,(填“增大”“减小”或“不变”)。
(2)图中表示NO2的变化的曲线是______,用氧气表示0—2s内该反应平均反应速率v(O2)= 。
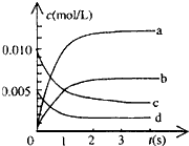
(3)求达平衡时NO的转化率为 。
(4)能说明该反应已经达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内的密度保持不变
(5)能够使该反应的反应速率增大,且平衡向正反应方向移动的是______。
a.及时分离出NO2气体 b.增大O2的浓度
c.适当升高温度 d.使用高效催化剂
(普通班做)(1)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:____________________。


(2)氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:
N2(g)+3H2(g) 2NH3(g) ΔH="-92.4" kJ·mol-1。在定容密闭容器中,使2 mol N2和6 mol H2混合发生反应,平衡时N2转化率为20%:
2NH3(g) ΔH="-92.4" kJ·mol-1。在定容密闭容器中,使2 mol N2和6 mol H2混合发生反应,平衡时N2转化率为20%:
①当反应达到平衡时,N2和H2的浓度比是 N2和H2的转化率比是 ,反应共放热 KJ。
②升高平衡体系的温度,混合气体的平均相对分子质量 ,密度 (填“变大”“变小”或“不变”)。
③当达到平衡时,充入氩气 ,平衡将 (填“正向”“逆向”或“不”)移动。
④若容器绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“正向”“逆向”或“不”)移动。达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍。
(实验班做)合成氨工业中氢气可由天然气和水蒸汽反应制备,其主要反应为:
CH4+ 2H2O CO2+4H2,已知:
CO2+4H2,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890KJ/mol
2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ/mol
H2O(g)=H2O(l) △H=-44KJ/mol
(1)写出由天然气和水蒸汽反应制备H2的热化学方程式: 。
(2)某温度下,10L密闭容器中充入2mol CH4和3mol H2O(g),发生CH4(g)+ 2H2O(g)  CO2(g)+4H2(g)反应,过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2(g)反应,过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
则①平衡时,CH4的转化率为 ,H2的浓度为 ,反应共放出或吸收热量 KJ。
②升高平衡体系的温度,混合气体的平均相对分子质量 ,密度 。(填“变大”“变小”或“不变”)。
③当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
④若保持恒温,将容器压缩为5L(各物质仍均为气态),平衡将 (填“正向”“逆向”或“不”)移动。达到新平衡后,容器内H2浓度范围为 。
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1一定条件下,向体积为1L的密闭容器中充入lmolCO2和3mo1H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1一定条件下,向体积为1L的密闭容器中充入lmolCO2和3mo1H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是

| A.升高温度平衡常数K增大 |
| B.反应达到平衡状态时,CO2的平衡转化率为75% |
| C.3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol·L-1·min-1 |
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:下列说法正确的是
nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:下列说法正确的是
| /L积体气温体c(Y)/mol•L-1度/℃ |
1 |
2 |
3 |
| 100 |
1.00 |
0.75 |
0.53 |
| 200 |
1.20 |
0.90 |
0.63 |
| 300 |
1.30 |
1.00 |
0.70 |
A.m > n
B.Q < 0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
试题篮
()