恒温、恒压下,将1 mol O2和2 mol SO2气体充入一个体积可变的容器中(状态Ⅰ) ,发生反应:2SO2(g)+O2(g) 2SO3(g),状态Ⅱ时达平衡,则O2得转化率为:
2SO3(g),状态Ⅱ时达平衡,则O2得转化率为:
| A.60% | B.40% | C.80% | D.90% |
在平衡2CrO42-(黄色)+2H+ Cr2O32-(橙红色)+H2O中,溶液介于黄色和橙红色之间,欲使溶液的橙红色加深,则要在溶液中加入( )
Cr2O32-(橙红色)+H2O中,溶液介于黄色和橙红色之间,欲使溶液的橙红色加深,则要在溶液中加入( )
| A.H+ | B.OH- | C.K+ | D.H2O |
一定温度下,反应N2(g)+3H2(g) 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
| A.N2、H2和NH3的物质的量分数不再改变 |
| B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2 |
| C.N2与H2的物质的量之和是NH3的物质的量的2倍 |
| D.单位时间里每增加1 mol N2,同时增加3 mol H2 |
已知反应A(g)+3B(g)⇌2C(g)在一定温度下达到平衡,该反应的平衡常数表达式为 。
若各物质的平衡浓度分别为c(A)="2.0" mol/L、c(B)="2.0" mol/L、c(C)="1.0" mol/L,则K= 。
硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发展水平的一种标志。目前的重要生产方法是“接触法”,有关接触氧化反应2SO2+O2 2SO3,的说法不正确的是( )
2SO3,的说法不正确的是( )
| A.该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫 |
| B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零 |
| C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等 |
| D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题 |
关于化学平衡常数K,下列说法不正确的是 ( )
| A.K只随温度的改变而改变 |
| B.K>Q(Q为浓度熵)平衡正向移动 |
| C.正、逆反应的平衡常数数值相同,符号相反 |
| D.K值变化平衡一定发生移动 |
高温下,某可逆反应达到平衡,其平衡常数为K= ,恒容时,升高温度,H2的浓度减小,则下列说法正确的是( )
,恒容时,升高温度,H2的浓度减小,则下列说法正确的是( )
| A.该反应的焓变为正值 |
| B.升高温度,K值减小 |
| C.升高温度,逆反应速率减小 |
D.该反应的化学方程式为CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g) |
在一密闭容器中进行如下反应:3H2(气)+N2(气) 2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
| A.H2为 0.6mol/L、N2为 0. 2mol/L | B.NH3为 0.25mol/L |
| C.N2、NH3均为 0.15mol/L | D.NH3为 0.4mol/L |
可逆反应2SO2 (g)+ O2 (g)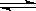 2SO3(g)达到平衡的标志是
2SO3(g)达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.只有③ | D.只有① |
在容积不变的密闭容器中,一定条件下发生反应:2A(?) B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
| A.若正反应是吸热反应,则A为非气态 |
| B.若正反应是放热反应,则A为非气态 |
| C.在平衡体系中加入少量C,该平衡向逆反应方向移动 |
| D.改变压强对该平衡的移动一定无影响 |
对可逆反应A(g)+2B(g) 3C(g),在其他条件不变的情况下,下列有关叙述不正确的是( )
3C(g),在其他条件不变的情况下,下列有关叙述不正确的是( )
A.单位时间内消耗amol(A),同时消耗3amolC时,反应处于平衡状态
B.增大容器的体积,化学平衡不移动,反应速率也不变
C.升高温度使c(B)增大,可知正反应为放热反应
D.加入催化剂,改变了反应历程,但反应的△H不会变
将2molA与2molB混合于2L的密闭容器中发生如下反应:2A(g)+3B(g) 2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是( )
2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是( )
A.v(C)=v(D)=0.25mol•L-1•s-1 B.z=2
C.C的体积分数为28.6% D.B的转化率为25%
已知反应:2NO2 (红棕色)  N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,下右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,下右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是

| A.b点的操作是拉伸注射器 |
| B.d 点:v(正) < v(逆) |
| C.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| D.若不忽略体系温度变化,且没有能量损失,则温度关系:T(b)>T(c) |
试题篮
()