已知反应:2CH3COCH3(l)⇌CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y﹣t)如图所示.下列说法正确的是( )

| A.b代表0℃下CH3COCH3的Y﹣t曲线 |
B.反应进行到20min末,CH3COCH3的 |
| C.升高温度可缩短反应达平衡的时间并能提高平衡转化率 |
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的 |
在一定温度不同压强(p1<p2)下,可逆反应2X(g) 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数()与反应时间(t)的关系有以下图示,正确的是( )
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数()与反应时间(t)的关系有以下图示,正确的是( )

下列有关研究化学反应原理的叙述中,正确的是
| A.研究化学反应中的能量变化,有利于通过改变反应条件,使同一反应消耗相同量的物质而放出更多的热,提高化学能的利用率 |
| B.任何放热的化学反应,均可以利用原电池直接把化学能转化为电能 |
| C.研究化学反应速率与化学平衡,有利于指导实际生产中达到“多,快,好,省”的生产效率 |
| D.使用催化剂常常可以加快化学反应速率,但不能提高反应物的转化率,因此在实际生产中较少使用催化剂 |
对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
| A.达到化学平衡时4v正(O2)=5v逆(NO) |
| B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达平衡状态 |
| C.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率关系是:3v正(NH3)=2v正(H2O) |
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)⇌Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )

| A.往平衡体系中加入金属铅后,C(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
已知:FeCl3(aq)+3KSCN(aq) 3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是
3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是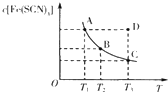
| A.A点与B点相比,A点的c( Fe3+)大 |
| B.加入KCl固体可以使溶液由D点变到C点 |
| C.反应处于D点时,一定有υ(正)<υ(逆) |
| D.若T1、T2温度下的平衡常数分别为K1、K2,则K1<K2 |
下列有关实验装置进行的相应实验,能达到实验目的的是( )
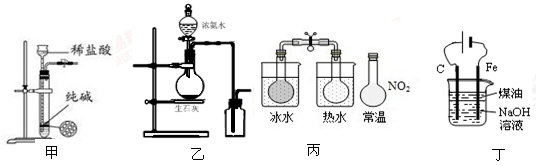
| A.用图甲所示装置控制制取少量的CO2气体 |
| B.用图乙所示装置制取并收集氨气 |
C.用图丙所示装置可以说明反应2NO2(g) N2O4(g)是放热反应 N2O4(g)是放热反应 |
| D.用图丁所示装置可制备Fe(OH)2并能较长时间观察其颜色 |
在一密闭容器中进行如下反应:3H2(气)+N2(气) 2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
| A.H2为 0.6mol/L、N2为 0. 2mol/L | B.NH3为 0.25mol/L |
| C.N2、NH3均为 0.15mol/L | D.NH3为 0.4mol/L |
可逆反应2SO2 (g)+ O2 (g)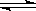 2SO3(g)达到平衡的标志是
2SO3(g)达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.只有③ | D.只有① |
在容积不变的密闭容器中,一定条件下发生反应:2A(?) B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
| A.若正反应是吸热反应,则A为非气态 |
| B.若正反应是放热反应,则A为非气态 |
| C.在平衡体系中加入少量C,该平衡向逆反应方向移动 |
| D.改变压强对该平衡的移动一定无影响 |
对可逆反应A(g)+2B(g) 3C(g),在其他条件不变的情况下,下列有关叙述不正确的是( )
3C(g),在其他条件不变的情况下,下列有关叙述不正确的是( )
A.单位时间内消耗amol(A),同时消耗3amolC时,反应处于平衡状态
B.增大容器的体积,化学平衡不移动,反应速率也不变
C.升高温度使c(B)增大,可知正反应为放热反应
D.加入催化剂,改变了反应历程,但反应的△H不会变
将2molA与2molB混合于2L的密闭容器中发生如下反应:2A(g)+3B(g) 2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是( )
2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是( )
A.v(C)=v(D)=0.25mol•L-1•s-1 B.z=2
C.C的体积分数为28.6% D.B的转化率为25%
已知反应:2NO2 (红棕色)  N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,下右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,下右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是

| A.b点的操作是拉伸注射器 |
| B.d 点:v(正) < v(逆) |
| C.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| D.若不忽略体系温度变化,且没有能量损失,则温度关系:T(b)>T(c) |
试题篮
()