下列事实中不能用勒夏特列原理加以解释的是( )
| A.压缩氢气与碘蒸气反应的平衡混合气体,颜色变深 |
| B.浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体 |
| C.夏天,打开啤酒瓶时会在瓶口逸出气体 |
| D.将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅 |
下列说法正确的是( )
| A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 |
| B.铁片镀锌时,铁片与外电源的正极相连 |
| C.以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 |
D.t℃时,恒容密闭容器中反应:NO2(g)+SO2(g) NO(g)+SO3(g),通入少量O2, NO(g)+SO3(g),通入少量O2,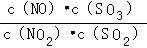 的值及SO2转化率不变 的值及SO2转化率不变 |
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g) N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
| A |
B |
C |
D |
 |
 |
 |
 |
| 0~3s内,反应速率v(O3)=0.2mol·L-1·s-1 |
降低温度,平衡常数增大 |
t1时仅加入催化剂,平衡正向移动 |
达平衡时,仅改变x,则x为c(O2) |
在一定条件下xA+yB zC达到平衡时,请填写:
zC达到平衡时,请填写:
(1)若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z关系是___________________。
(2)已知B、C是气体,现增加A的物质的量,平衡不移动,说明A是_________________(填状态)。
(3)若容器容积不变,加入气体B,气体A的转化率__________(填“增大”“减小”或“不变”)。
(4)若加热后,C的百分含量减小,则正反应是___________反应(填“放热”或“吸热”)。
(5)若容器容积不变,且A、B、C都是气体,向容器中充入稀有气体,则 。
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不移动 D.反应停止
下列事实能用勒夏特列原理解释的是( )
A.FeCl3+3KSCN Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
B.工业合成氨中,将氨气液化分离
C.A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B中试管中产生气泡快
D.对于反应2NO2(g) N2O4(g) △H<0,升高温度可使体系颜色变深
N2O4(g) △H<0,升高温度可使体系颜色变深
一定温度下,在固定容积的密闭容器中,发生可逆反应2A(g)+3B(s) 2C(g),下列叙述不是达到平衡的标志的是( )
2C(g),下列叙述不是达到平衡的标志的是( )
①单位时间生成a mol A,同时消耗1.5a mol B
②C的生成速率与C的分解速率相等
③各组分的浓度不再变化
④混合气体的密度不再变化
⑤混合气体的总压强不再变化
⑥A、B、C的分子数目比为2:3:2
⑦混合气体的平均摩尔质量不再变化
⑧混合气体的物质的量不再变化
A.④⑥⑦ B.⑤⑥⑧ C. ①③④ D.①⑤⑧
下列变化不能用勒夏特列原理解释的是
| A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| B.合成氨工业中使用催化剂,以提高NH3的产量 |
| C.红棕色的NO2加压后颜色先变深再变浅 |
D.CO2(g) CO2(aq)ΔH<0,降温增压可增大二氧化碳气体在水中的溶解度 CO2(aq)ΔH<0,降温增压可增大二氧化碳气体在水中的溶解度 |
在一密闭容器中进行如下反应:3H2(气)+N2(气) 2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
| A.H2为 0.6mol/L、N2为 0. 2mol/L | B.NH3为 0.25mol/L |
| C.N2、NH3均为 0.15mol/L | D.NH3为 0.4mol/L |
可逆反应2SO2 (g)+ O2 (g)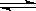 2SO3(g)达到平衡的标志是
2SO3(g)达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.只有③ | D.只有① |
在容积不变的密闭容器中,一定条件下发生反应:2A(?) B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
| A.若正反应是吸热反应,则A为非气态 |
| B.若正反应是放热反应,则A为非气态 |
| C.在平衡体系中加入少量C,该平衡向逆反应方向移动 |
| D.改变压强对该平衡的移动一定无影响 |
对可逆反应A(g)+2B(g) 3C(g),在其他条件不变的情况下,下列有关叙述不正确的是( )
3C(g),在其他条件不变的情况下,下列有关叙述不正确的是( )
A.单位时间内消耗amol(A),同时消耗3amolC时,反应处于平衡状态
B.增大容器的体积,化学平衡不移动,反应速率也不变
C.升高温度使c(B)增大,可知正反应为放热反应
D.加入催化剂,改变了反应历程,但反应的△H不会变
将2molA与2molB混合于2L的密闭容器中发生如下反应:2A(g)+3B(g) 2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是( )
2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断不正确的是( )
A.v(C)=v(D)=0.25mol•L-1•s-1 B.z=2
C.C的体积分数为28.6% D.B的转化率为25%
已知反应:2NO2 (红棕色)  N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,下右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,下右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是

| A.b点的操作是拉伸注射器 |
| B.d 点:v(正) < v(逆) |
| C.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| D.若不忽略体系温度变化,且没有能量损失,则温度关系:T(b)>T(c) |
试题篮
()