二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成:
2H2(g)+CO(g)  CH3OH(g) ΔH=" —90.0" kJ·mol-1 ①
CH3OH(g) ΔH=" —90.0" kJ·mol-1 ①
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=" —24.5" kJ·mol-1 ②
CH3OCH3(g)+H2O(g) ΔH=" —24.5" kJ·mol-1 ②
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=" —41.1" kJ·mol-1 ③
CO2(g)+H2(g) ΔH=" —41.1" kJ·mol-1 ③
(1)反应①的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下该反应自发进行。
(2)在250℃的恒容密闭容器中,下列事实可以作为反应③已达平衡的是 (填选项字母)。
| A.容器内气体密度保持不变 | B.CO与CO2的物质的量之比保持不变 |
| C.H2O与CO2的生成速率之比为1∶1 | D.该反应的平衡常数保持不变 |
(3)当合成气中CO与H2的物质的量之比恒定时,温度、压强对CO转化率的影响如图1所示。图1中A点的v(逆) B点的v(正)(填“>”、“<”或“=”),说明理由 。实际工业生产中该合成反应的条件为500℃、4MPa请回答采用500℃的可能原因 。


(4)一定温度下,密闭容器中发生反应③,水蒸气的转化率与n(H2O)∕n(CO)的关系如图:计算该温度下反应③的平衡常数K= 。在图2中作出一氧化碳的转化率与n(H2O)∕n(CO)的曲线。
在25℃下,已知反应:①NH3·H2O+H+ NH4+ + H2O(平衡常数为K1);
NH4+ + H2O(平衡常数为K1);
②Ag++2 NH3·H2O Ag(NH3)2++ 2H2O(平衡常数为K2),且K1> K2。下列说法不合理的是
Ag(NH3)2++ 2H2O(平衡常数为K2),且K1> K2。下列说法不合理的是
A.25℃时,将0.02 mol·L-1的氨水与a mol·L-1的盐酸等体积混合(体积变化忽略不计),反应后溶液呈中性,则用含a的代数式表示NH3·H2O的电离常数为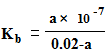 |
| B.往银氨溶液中加水稀释,反应②平衡向逆反应方向移动 |
| C.若往银氨溶液中加入足量的盐酸,则溶液中会产生白色浑浊 |
| D.已知:H+(aq)+ OH-(aq)=H2O(l)DH = -57.3 kJ·mol-1,则1 L 0.1 mol ·L-1氨水和足量的盐酸反应放出的热量等于5.73 kJ |
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡的是___________;
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数___________;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量___________(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H______0;
(2)已知:NH2COONH4+2H2O⇌NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率______________;
⑥根据图中信息,如何说明水解反应速率随温度升高而增大_____________________。
2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+Cl2(g)⇌PCl5(g)达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
| A.0.40 mol | B.0.20 mol |
| C.小于0.20 mol | D.大于0.20 mol,小于0.40 mol |
全球气候变暖已经成为全世界人类面临的重大问题,温家宝总理在“哥本哈根会议”上承诺到2020年中国减排温室气体40%.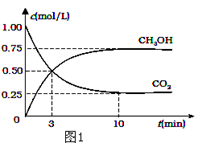
(1)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为2L的恒容密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=___mol/(L•min);
②氢气平衡时的物质的量浓度为___________;
③下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是___________.
| A.升高温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 |
| D.再充入1mol CO2和3mol H2 |
④当反应达到平衡时, H2的物质的量浓度为c1,然后向容器中再加入1mol CH3OH和1mol H2O,待反应再一次达到平衡后,H2的物质的量浓度为c2.则c1______c2的关系(填>、<、=).
(2)减少温室气体排放的关键是节能减排,大力开发利用燃料电池就可以实现这一目标.如图2所示甲烷燃料电池就是将电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.将其插入KOH溶液从而达到吸收CO2的目的.请回答:
①通入甲烷一极的电极反应式为___________;
②随着电池不断放电,电解质溶液的pH______(填“增大”、“减小”或“不变”).
③通常情况下,甲烷燃料电池的能量利用率___________(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H1=﹣116kJ•mol﹣1
CH3OH(g) △H1=﹣116kJ•mol﹣1
(1)下列措施中有利于增大该反应的反应速率且利于反应正向进行的是___________。
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.增大体系压强 d.使用高效催化剂
(2)已知:CO(g)+ O2(g)═CO2(g) △H2=﹣283kJ•mol﹣1
O2(g)═CO2(g) △H2=﹣283kJ•mol﹣1
H2(g)+ O2(g)═H2O(g) △H3=﹣242kJ•mol﹣1
O2(g)═H2O(g) △H3=﹣242kJ•mol﹣1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为________________________。
(3)在容积为2L的恒容容器中,分别研究在三种不同温度下合成甲醇,右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系.请回答:
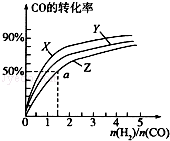
①在图中三条曲线,对应的温度由高到低的顺序是_________________。
②利用a点对应的数据,计算出曲线Z在对应温度下CH3OH(g) CO(g)+2H2(g)的平衡常数:K=_______________。
CO(g)+2H2(g)的平衡常数:K=_______________。
(4)恒温下,分别将1molCO和2molH2置于恒容容器I和恒压容器Ⅱ中(两容器起始容积相同),充分反应.
①达到平衡所需时间是I_________Ⅱ(填“>”、“<”或“=”,下同).达到平衡后,两容器中CH3OH的体积分数关系是I________Ⅱ。
②平衡时,测得容器I中的压强减小了30%,则该容器中CO的转化率为_______。
一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
| 容器编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
||
| Ⅰ |
387 |
0.20 |
0.080 |
0.080 |
| Ⅱ |
387 |
0.40 |
|
|
| Ⅲ |
207 |
0.20 |
0.090 |
0.090 |
下列说法正确的是( )
A.该反应的正方应为吸热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol 和H2O 0.10 mol,则反应将向正反应方向进行
T ℃时,在V L恒容密闭容器中加入足量的TaS2(s)和1 mol I2(g),发生反应TaS2(s)+2I2(g)  TaI4(g)+S2(g) ΔH>0。t min时生成0.1 mol TaI4。下列说法不正确的是( )
TaI4(g)+S2(g) ΔH>0。t min时生成0.1 mol TaI4。下列说法不正确的是( )

A.0~t min内,v(I2)= mol·L-1·min-1 mol·L-1·min-1 |
B.若T ℃时反应的平衡常数K=1,则平衡时I2的转化率为 |
| C.图中制备TaS2晶体过程中循环使用的物质是I2(g) |
| D.图中T1端得到纯净TaS2晶体,则温度T1<T2 |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
| 容器 编号 |
起始时各物质的物质的量/mol |
达到平衡时体 系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出能量:23.15 kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量<23.15 kJ
下列说法正确的是( )
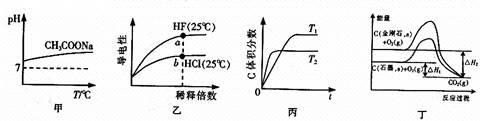
| A.由图甲可知,升高温度醋酸钠的水解程度增大 |
| B.由图乙可知,a点Kw的数值比b点Kw的数值大 |
C.由图丙可知,反应A(g)+B(g) 2C(g)是吸热反应 2C(g)是吸热反应 |
| D.由图丁可知,反应C(金刚石,s) = C(石墨,s)的焓变△H =△H1-△H2 |
一定条件下,在一个容积为2L的密闭容器中加入0.8mol A2气体和0.6mol B2气体反应达平衡生成1mol AB气体并释放出热量,反应中各物质的浓度随时间的变化情况如图所示.下列说法不正确的是( )

| A.图中a点的值为0.15 |
| B.该反应的平衡常数K=0.03 |
| C.温度升高,平衡常数K值减小 |
| D.平衡时A2的转化率为62.5% |
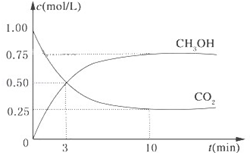
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L•min);
(2)氢气的转化率= _____;
(3)该反应的平衡常数为 _____(保留小数点后2位);
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 ___。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 | D.再充入1mol H2 |
(5)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1 c2的关系(填“>”、“<”或“=”)
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) 2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

| A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对化学平衡的影响,且甲的催化效率比乙高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(CH3OH)]2,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
请回答下列问题:
(1)写出上述反应的化学方程式 .
(2)该反应的正反应是 反应(填“放热”或者“吸热”)
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:

①此时系统温度400℃,比较正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”).
②若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中 点.比较图中B、D两点所对应的正反应速率B D(填“>”、“<”或 “=”).理由是 .
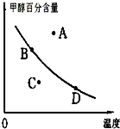
(4)一定条件下要提高反应物的转化率,可以采用的措施是
a.升高温度 b.加入催化剂
c.压缩容器的体积 d.增加水蒸气的浓度
e.及时分离出产物.
试题篮
()