煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g) CH4(g)
CH4(g)
在VL的容器中投入a mol碳(足量),同时通入a mol H2,控制条件使其发生上述反应,实验测得H2的平衡转化率随压强及温度的变化关系如图所示。下列说法正确的是
| A.上述逆反应为吸热反应 |
B.在5MPa, 800K时,该反应的平衡常数为 |
C.在4MPa, 1200K时,图中X点 |
| D.工业上维持6 MPa、1000K而不采用10 MPa、1000K,主要是因为前者氢气的转化率高 |
(15分)
I.已知甲和乙在溶液中的转化关系如图所示:
请回答下列问题:
(1)若甲是10电子的单核微粒,乙是两性氢氧化物,则微粒甲的原子结构示意图为________________。
(2)若甲是10电子的阳离子,乙是碱性气体。lmol乙通人足量强酸溶液中与H+反应,反应过程中能量变化如图,该反应的热化学方程式是__________________________。
(3)若甲仅含有N03-、SO42-和X三种离子(不考虑水电离的H+、OH-),则X离子可能是_____________(填序号)。
| A.Fe2+ | B.HC03- | C.Ba2+ | D.Fe3+ |
(4)若甲是CO2,乙中HCO3-和CO32-的物质的量浓度相等,此时溶液的pH=a,则HCO3-的电离平衡常数Ka=___.
Ⅱ.在恒容密闭容器中通入X并发生反应:  ,温度
,温度
下X的物质的量浓度c(X)随时间t变化的曲线如图所示。
(5)温度 ___________
___________ (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(6)M点的正反应速率 __________N点的逆反应速率
__________N点的逆反应速率 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(7)该反应进行到M点放出的热量与进行到W点放出的热量相比:_____________(填“更多”、“更少”或“相同”)
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是 。
(2)Ⅱ中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(ρ1、ρ2)下随温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(ρ1、ρ2)下随温度变化的曲线(如图)。
①比较ρ1、ρ2的大小关系: 。
②随温度升高,该反应平衡常数变化的趋势是 。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
(1)已知:2NO(g) N2O4(g) ΔH1
N2O4(g) ΔH1
2NO2(g) N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母) 。

②N2O4与O2、H2O化合的化学方程式是 。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。为使电解产物全部转化为NH4NO3,需补充物质A。A是 ,说明理由 。
(16分)物质的类别和核心元素的化合价是研究物质性质的两个基本视角。
(1)图中X的电子式为 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O (填“强”或“弱”)。用原子结构解释原因:同主族元素最外层电子数相同,从上到下, ,得电子能力逐渐减弱。
(2)Na2S2O3是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的从氧化还原反应的角度制备, ,理论上有可能的是 (填字母序号)。
a.Na2S+S b.Z+S c.Na2SO3+Y d.NaHS+NaHSO3
②已知反应:Na2S2O3+H2SO 4Na2SO4+S↓+SO2↑+H2O。研究其反应速率时,下列说法正确的是 (填写字母序号)。
4Na2SO4+S↓+SO2↑+H2O。研究其反应速率时,下列说法正确的是 (填写字母序号)。
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度、温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体。
①已知:CO(g)+1/2O2(g)=CO2(g) △H=-283kJ·mol-1
S(s)+O2(g)=SO2(g) △H=-296kJ·mol-1
则治理烟道气反应的热化学方程式为 。
②一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是 (填写字母序号)。
a.v(CO)∶v(SO2)=2∶1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为 ,则SO2的转化率为 。
,则SO2的转化率为 。
(4)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式 。
(5)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
吸收CO2最合适的试剂是 (填“Ca(OH)2”或“Ba(OH)2”)溶液。
黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源。
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题20图-1所示:
① a反应中每生成1molFeSO4转移电子的物质的量为 mol。
② d反应的离子方程式为 。
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题20图-2
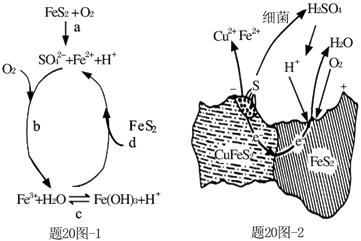
①冶炼过程中,正极周围溶液的pH (选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为 。
|
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题20图-3。
| 相关反应 |
反应热 |
平衡常数K |
FeS2(s) + H2(g)  FeS(s) + H2S(g) FeS(s) + H2S(g) |
ΔH1 |
K1 |
1/2 FeS2(s) + H2(g) 1/2Fe(s)+H2S(g) 1/2Fe(s)+H2S(g) |
ΔH2 |
K2 |
FeS(s) + H2(g) Fe(s)+H2S(g) Fe(s)+H2S(g) |
ΔH3 |
K3 |
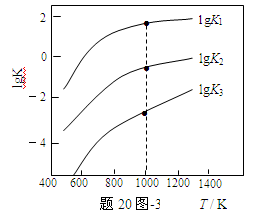
①上述反应中,ΔH1 0(选填:“>”或“<”)。
②提高硫的脱除率可采取的措施有 (举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为 。
在三个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件发生反应:2CO2(g)+6H2 (g) C2H4(g) + 4H2O(g) ΔH。CO2的平衡转化率与温度的关系如下图所示。
C2H4(g) + 4H2O(g) ΔH。CO2的平衡转化率与温度的关系如下图所示。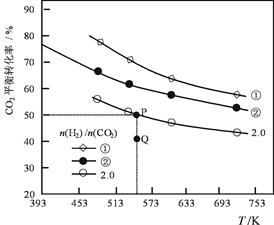
下列说法正确的是
| A.该反应的ΔH<0 |
| B.氢碳比:①<② |
| C.在氢碳比为2.0时,Q点v(正)<v(逆) |
| D.若起始时,CO2、H2浓度分别为0.5mol/L和1.0mol/L,则可得P点对应温度的平衡常数的值为512 |
Ⅰ.在含有弱电解质的溶液中,往往有多个化学平衡共存。一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入少量CH3COONa固体。
(1)CH3COOH溶液的电离平衡 移动(填“向左”、“向右”或“不”),溶液中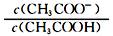 (填“增大”、“减小”或“不变”);
(填“增大”、“减小”或“不变”);
(2)若该溶液呈酸性,则溶液中各离子浓度由大到小的顺序为: 。
Ⅱ、开发新能源和三废处理都是可持续发展的重要方面。
(1)H2、CO、CH3OH都是重要能源物质,它们燃烧热依次为285.8KJ/mol、281.5KJ/mol、726.7KJ/mol.已知CO、H2在一定条件下可以合成甲醇CO(g)+2H2(g)=CH3OH(l)。则该合成甲醇的热化学方程式为
(2)CO在催化剂作用下可以与H2反应生成甲醇:
CO(g)+2H2(g) CH3OH(g)。在密闭容器中充入10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充入10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。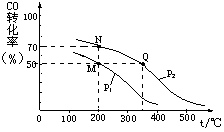
则M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 ;P1 P2(填“>”或“<”或“=”);
M、N两点平衡状态下,容器中物质的总物质的量之比为:n(M)总:n(N)总= 。
二氧化硫和氮氧化物都是常见的大气污染物,回答下列相关问题。
Ⅰ某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i.2NO(g)+Cl2(g) 2ClNO(g) △H1< 0 其平衡常数为K1
2ClNO(g) △H1< 0 其平衡常数为K1
ii.2NO2(g)+NaCl(s)  NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
(1)现有反应4NO2(g)+2NaCl(s)  2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3= (用K1、K2表示),反应热△H3= (用△H1、△H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3= (用K1、K2表示),反应热△H3= (用△H1、△H2表示)。
(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:
①10min内υ(ClNO) = ,平衡常数K2= ;
②若其它条件不变,使反应在恒压条件下进行,平衡时NO2转化率为α2(NO2),则:
α1(NO2) = α2(NO2)(填“>”“<”或“=”)。
II除氮氧化物外,SO2也是重要的大气污染物,需要对其进行吸收处理。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是 。
| A.c(Na+) = c(HSO3-)+ 2c(SO32-) |
| B.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—) |
| C.2c(Na+) =2c(H2SO3)+2c(HSO3-)+2c(SO32-) |
| D.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3) |
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如图所示,则
①工作一段时间后,阴极区溶液的pH (填“增大”“减小”或“不变”);
②写出阳极的电极反应式 。
将等物质的量的N2、H2混合于2L的固定体积的密闭容器中,在一定条件下反应合成氨,经5min后达到平衡,其中C(N2):C(H2) = 3︰1;若将混合气体中氨气分离,恰好能与250mL 2mol/L的稀硫酸溶液反应生成正盐;
求:(1)NH3的化学反应速率是多少?
(2)原容器中N2的物质的量是多少?
(3)5min后容器中H2的物质的量浓度是多少?
(4)N2的转化率是多少?
(要求书写计算过程)
(15分)卤素的单质及其化合物在生产、生活中应用广泛。
(1)“碘盐"通常是在食盐中添加适量的K1O3,为缺碘地区人们提供碘元素。
①碘元素的一种原子含74个中子、5 3个质子,表示此核素的符号是___(如 )。
)。
②“碘盐"溶液用稀硫酸酸化后,再加入淀粉碘化钾溶液,溶液由无色变篮色。
写出该反应的化学方程式__________________________________________。
③碘单质溶解在有机溶剂___________中形成常用的医用消毒剂(填结构简式)。
(2)工业上利用氢气和氯气反应制取盐酸,设计成原电池又能获取电能,下列说法错误的是___(填选项)。
| A.两极材料可用石墨,用稀盐酸做电解质溶液 |
B.通氯气的电极反应式为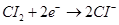 |
| C.电解质溶液中的阳离子向通氯气的电极移动‘ |
| D.通入氢气的电极为原电池的正极 |
(3)H2和卤素单质(F2、C12、Br2、12)反应生成I molHX的能量变化如图所示(反应物和产物均为298K时的稳定状态)。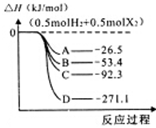
①曲线A代表的卤化氢是__________(填化学式)。
②写出Br2(1)与HCI气体反应的热化学方程式___________。
③往甲乙两容器分别通入等量的H2和I2,两容器起始状态相同,甲为恒容绝热密闭容器,乙为恒容恒温密闭容器,发生反应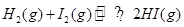 ,反应达到平衡后,H2的体积分数甲_______乙(填“>’’‘‘=”或“<”)。
,反应达到平衡后,H2的体积分数甲_______乙(填“>’’‘‘=”或“<”)。
人工固氮是指将氮元素由游离态转化为化合态的过程。
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。
总反应式为N2+3H2 2NH3。则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”);
2NH3。则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”);
向另一电极通入N2,该电极的反应式为__________________________。
II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3相应的反应方程式为:2N2(g)+6H2O(g)  4NH3(g)+3O2(g)△H=Q
4NH3(g)+3O2(g)△H=Q
(1)上述反应的平衡常数表达式为_______________。
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数 (N2)与反应温度T的关系曲线如下图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
(N2)与反应温度T的关系曲线如下图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
(3)若上述反应在有催化剂的情况下发生,则下图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是_______(填字母代号),图中△H绝对值为1530kJ·mol-1。
III.目前工业合成氨的原理是:N2(g)+3H2 (g)  2NH3(g)△H=-93.0kJ·mol-1
2NH3(g)△H=-93.0kJ·mol-1
回答下列问题:
结合II中的数据,则2H2 (g)+O2 (g)=2H2O(g)的△H=___________。
(2)在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。
①达平衡时,H2的转化率 ______________。
______________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为a2,当a1+a2=1时,则起始时NH3的物质的量n(NH3)= _________mol。
新的研究表明二甲醚(DME)是符合中国能源结构特点的优良车用替代燃料,二甲醚催化重整制氢的反应过程,主要包括以下几个反应(以下数据为25℃、1.01×105Pa测定):
①CH3OCH3(g) + H2O(l)  2 CH3OH(l) △H=+24.52kJ/mol
2 CH3OH(l) △H=+24.52kJ/mol
②CH3OH(l) + H2O(l)  CO2(g) + 3H2(g) △H=+49.01kJ/mol
CO2(g) + 3H2(g) △H=+49.01kJ/mol
③CO(g) + H2O(l)  CO2(g) + H2(g) △H=-41.17kJ/mol
CO2(g) + H2(g) △H=-41.17kJ/mol
④CH3OH(l)  CO (g) + 2H2(g) △H=+90. 1kJ/mol
CO (g) + 2H2(g) △H=+90. 1kJ/mol
请回答下列问题:
(1)写出用二甲醚制H2同时全部转化为CO2时反应的热化学方程式___________。
(2)200℃时反应③的平衡常数表达式K=___________。
(3)在一常温恒容的密闭容器中,放入一定量的甲醇如④式建立平衡,以下可以作为该反应达到平衡状态的判断依据为___________。
A.容器内气体密度保持不变
B.气体的平均相对分子质量保持不变
C.CO的体积分数保持不变
D.CO与H2的物质的量之比保持1:2不变
(4)工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如下图所示,
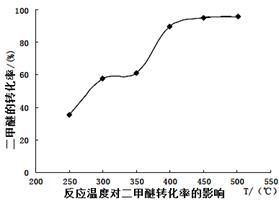
①你认为反应控制的最佳温度应为___________。
A.300~350℃ B.350~400℃ C.400~450℃ D.450~500℃
②在温度达到400℃以后,二甲醚与CO2以几乎相同的变化趋势明显降低,而CO、H2体积分数也以几乎相同的变化趋势升高,分析可能的原因是___________(用相应的化学方程式表示)。
(5)某一体积固定的密闭容器中进行反应②,200℃时达平衡。请在下图补充画出:t1时刻升温,在t1与t2之间某时刻达到平衡;t2时刻添加催化剂,CO2的百分含量随时间变化图像。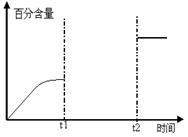
已知可逆反应2A(g)+B(g) 2C(g),向容积为0.5L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得
2C(g),向容积为0.5L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得 ,放出热量Q1 kJ。
,放出热量Q1 kJ。
(1)能说明上述反应已经达到化学平衡状态的是______________(填字母编号)
a.v(C)=2v(B)
b.单位时间内生成2mol A的同时消耗1molB
c.容器内压强保持不变
d.容器内气体的密度保持不变
e.单位时间内生成1molB的同时生成2mol A
f.容器内气体的平均分子量保持不变
g.容器内气体的质量保持不变
h.容器内A物质的浓度是B物质的2倍
(2)上述反应中A的转化率a(A)= 。
(3)请写出上述反应的热化学方程式__________________。
(4)500℃时,上述反应的化学平衡常数K=____________________。
(5)一般,升高温度,化学反应的反应速率会增大。从以下图像中选择符合酶催化作用的化学反应速率随温度变化的特征 。
高炉炼铁过程中发生的主要反应为:Fe2O3(s) + 3CO(g) 2Fe(s) + 3CO2(g)。已知该反应在不同温度下的平衡常数列于表中:
2Fe(s) + 3CO2(g)。已知该反应在不同温度下的平衡常数列于表中:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
64.0 |
50.653 |
42.875 |
(1)写出该反应的平衡常数表达式:K=____ _____。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)= ;平衡时,c(CO)= 。
(3)欲提高(2)中CO的反应速率,可采取的措施是_____________。
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的体积
F.加入合适的催化剂
(4)在1L的密闭容器中,1300℃条件,下列达平衡状态的是 。
| n(Fe2O3) |
0.350 |
0.027 |
0.080 |
0.080 |
| n(CO) |
0.010 |
0.010 |
0.010 |
0.050 |
| n(Fe) |
0.100 |
0.064 |
0.080 |
0.080 |
| n(CO2) |
0.035 |
0.088 |
0.040 |
0.050 |
(5)铁是国家的工业基础,下列哪些装置可防止铁棒被腐蚀 ________。
试题篮
()