C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学方程式为______________________________________。
已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1;
S(s)+O2=SO2(g) △H=-296.0 kJ·mol-1
(2)向甲、乙两个均为1L的密闭容器中,分别充入5mol SO2和3mol O2,发生反应:
2 SO2(g)+O2(g) 2SO3(g) △H<0
2SO3(g) △H<0
甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6mol。
则T1________T2(填“>”“<”),甲容器中反应的平衡常数K=___________。
(3)如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将1 mol N2和3mol H2通过K1、K3充入A、B中,发生的反应为:N2(g)+3H2(g)  2NH3(g),起始时A、B的体积相同均为a L。
2NH3(g),起始时A、B的体积相同均为a L。
①下列示意图正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是_ __。
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率v(H2)=____。
(4)将0.1mol氨气分别通入1L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为______(用c1、c2、c3和>、<、=表示)。已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10-5 mol·L-1,则该温度下0.1 mol·L-1的NH4Cl溶液的pH为_________。
将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g)+aQ(g);ΔH ="b" kJ/mol。达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol/L,下列叙述正确的是
2Z(g)+aQ(g);ΔH ="b" kJ/mol。达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol/L,下列叙述正确的是
| A.平衡时X与Y的转化率相等 |
| B.平衡时X的浓度为0.2 mol/L |
| C.在相同实验条件下,若在同一个容器中改为加入2 mol Z和2 mol Q,达到新平衡时Z的体积分数为20% |
| D.若升高温度,Y的体积分数增大,则b<0 |
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3)。CCl4+H2 CHCl3+HCl此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
CHCl3+HCl此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)。
| 实验 序号 |
温度℃ |
初始CCl4浓度 (mol·L—1) |
初始H2浓度(mol·L—1) |
CCl4的平衡转化率 |
| 1 |
110 |
1 |
1.2 |
A |
| 2 |
110 |
1 |
1 |
50% |
| 3 |
100 |
1 |
1 |
B |
(1)此反应在110℃时平衡常数为 。
(2)实验l中,CCl4的转化率A 50%(填“大于”、“小于”或“等于”)。
(3)实验3中,B的值 (选填序号)。
A.等于50% B.大于50%
C.小于50% D.从本题资料,无法判断
(4)120℃,在相同条件的密闭容器中,分别进行H2的初始浓度为2 mol·L-1和4 mol·L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3,的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。在图中的四条线中,表示H2起始浓度为2mol·L一1实验的消耗CCl4的百分率变化曲线是 ________(选填序号)。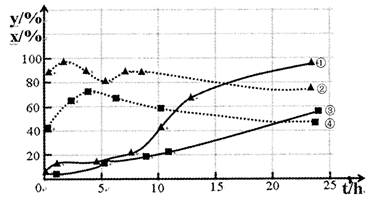
(10分)在温度为373K时,将0.100mol无色的N2O4气体通入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
(1)计算在20至40秒时间内,NO2的平均生成速率为 。
(2)该反应的化学平衡常数表达式为 。
(3)下表是不同温度下测定得到的该反应的化学平衡常数。
| T/ K |
323 |
373 |
| K值 |
0.022 |
0.36 |
据此可推测该反应(生成NO2)是 反应(选填“吸热”或“放热”)。
(4)若其他条件不变,反应在423K时达到平衡,请在上图中找出相应的位置,画出此温度下的反应进程示意曲线。
(14分)研究表明:丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图1表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。写出230℃该反应的热化学方程式: _______________ 。
(2)在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如上图2所示。
①能说明该反应已经达到平衡状态的是_______________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=________。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(3)某甲醇燃料电池原理如图1所示。
①M区发生反应的电极反应式为_________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300 mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为_______(忽略溶液体积变化)。
PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5试样的pH 。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
则N2和O2反应生成NO的热化学反应方程式为_________________。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
①用离子方程式表示反应器中发生的反应:_________________。
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_________________。
(4)为了改善环境,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①有效“减碳”的手段之一是节能,下列制氢方法最节能的是________(填序号)。
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O(g) 2H2+O2
2H2+O2
C.太阳光催化分解水制氢
2H2O 2H2↑+O2↑
2H2↑+O2↑
D天然气制氢:CH4+H2O(g) CO+3H2
CO+3H2
②CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g);ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
从3 min到9 min,v(H2)=_______mol·L-1·min-1。
③能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
④工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g)  CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。
| 温度/℃ |
0 |
100 |
200 |
300 |
400 |
| 平衡常数 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 MPa)和250 ℃,是因为此条件下,原料气转化率最高
尿素[CO(NH2)2]是首个由无机物人工合成的有机物。
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为______________________________。
(2)当氨碳比n(NH3)/ n(CO2)=4时,CO2的转化率随时间的变化关系如下图所示。
①A点的逆反应速率v逆(CO2)________B点的正反应速率v正(CO2)(填“大于”、“小于”或“等于”)。
②NH3的平衡转化率为________。
③一定温度下,在一个容积不变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)。
a.容器中的压强不变 b.3mol N—H键断裂的同时断裂2 molH—O键
c.c(CO2)=c(H2O) d..c(CO2)的浓度保持不变
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如下图所示。
①电源的负极为________(填“A”或“B”)。
②阳极室中发生的反应依次为___________________、___________________。
③电解结束后,阴极室溶液的pH与电解前相比将________(填“增大”、“减小”或“不变”);若两极共收集到气体11.2 L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
(17分)氮及其化合物在工业生产和科技等领域有广泛应用。
(1)肼(N2H4)常用于火箭或原电池的燃料。已知:(i)N2(g)+2O2(g)=2NO2(g) ΔH=+67.7kJ/mol
(ii)N2H4(g)+ O2(g) N2(g)+2H2O(g) ΔH=-534kJ/mol
N2(g)+2H2O(g) ΔH=-534kJ/mol
(iii)H2O(g)= H2O(1) ΔH=-44kJ/mol
①反应2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l) ΔH =_______kJ·mol-1
②一定温度下,将N2H4与NO2以体积比1:1置于10 L密闭容器中发生反应2N2H4(g)+ 2NO2(g) 3N2(g)+4H2O(1),下列不能说明反应达到平衡状态的是_______。(填序号)
3N2(g)+4H2O(1),下列不能说明反应达到平衡状态的是_______。(填序号)
a.混合气体密度保持不变 b.混合气体颜色保持不变
c.N2H4与NO2体积比保持不变 d.体系压强保持不变
③在10 L的密闭容器中发生上述反应,容器内部分物质的物质的量变化如下表:
前2min内NO2的平均反应速率为___________。平衡时NO2的转化率________;该温度下反应的平衡常数K=_________。
反应在第6min时改变了条件,改变的条件可能是__________。(填序号)
a.使用催化剂 b.升高温度 c.减小压强 d.增加NO2的量
(2)HNO3和As2S3能发生反应:As2S3+10HNO3==2H3AsO4+3S+10NO2↑+2H2O,反应中被氧化的元素为_________。
若该反应中转移电子的物质的量为5 mol时,产物中的S经过转化全部生成浓H2SO4,然后与足量的铜在加热条件下反应消耗铜的量_________。(填序号)
a.小于0.75 mol b.等于0.75mol c.大于0.75mol d.无法确定
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
(1)对于密闭容器中的反应:N2(g)+3H2(g)═2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.
下列叙述正确的是 (填选项).
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
(2)已知N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ•mol﹣1
①合成氨工业采取的下列措施不可用平衡移动原理解释的是 (填选项).
A.采用较高压强(20MPa~50MPa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来
②在容积均为2L(容器体积不可变)的甲、乙两个容器中,分别加入2molN2、6molH2和1molN2、3molH2,在相同温度、催化剂下使其反应.最终达到平衡后,两容器N2转化率分别为α甲、α乙,则甲容器中平衡常数表达式为 (用含α甲的代数式表示,化简为最简式),此时α甲 α乙(填“>”、“<”“=”).
碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N-NH2,氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式________________________________________。
(2)298 K时,在2L的密闭容器中,发生可逆反应:
2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0)
N2O4(g) ΔH=-a kJ·mol-1 (a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题。
①298k时,该反应的平衡常数为________。
②在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
试分析图中a、b、c、d、e五个点,
①水的电离程度最大的是__________;
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是 ;
③在c点,溶液中各离子浓度由大到小的排列顺序是_______。
已知某温度下:
反应①:CO2(g)+H2(g) CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
CO(g)+H2O(g),ΔH=" +41.2" kJ/mol;
反应②: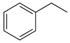 (g)
(g)
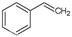 (g)+H2(g),ΔH=" +117.6" kJ/mol。
(g)+H2(g),ΔH=" +117.6" kJ/mol。
①、②的化学反应平衡常数分别为K1、K2。
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K1、K2表示)。
(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2。请画出t1之后的正逆反应曲线,并作出标注。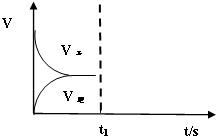
(3)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.50mol/L、c(N2O4)="0.125" mol/L,则2NO2(g) N2O4(g)的平衡常数K= (写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为 。
N2O4(g)的平衡常数K= (写出计算结果) ;若NO2起始浓度为2 mol/L,在相同条件下反应达到平衡时,NO2的转化率为 。
(4)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1 000 |
1 200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
①该反应为________反应(填“吸热”、“放热”)。
②能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A.及时分离出CO气体 B.适当升高温度
C.增大CO2的浓度 D.选择高效催化剂
、碳和氮的化合物与人类生产、生活密切相关。

(1)在一恒温、恒容密闭容器中发生反应:Ni (s)+4CO(g) Ni(CO)4(g),ΔH<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是 (填字母编号)。
Ni(CO)4(g),ΔH<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是 (填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
| B.缩小容器容积,平衡右移,ΔH减小 |
| C.反应达到平衡后,充入CO再次达到平衡时, CO的体积分数降低 |
| D.当4v正[Ni(CO)4]= v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
(2)CO与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:CO (g)+1/2O2(g)=CO2(g) ΔH=-Q1 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-Q2 kJ·mol-1
则SO2(g)+2CO (g)=S(s)+2CO2(g) ΔH= 。
(3)对于反应:2NO(g)+O2 2NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
2NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
①比较P1、P2的大小关系:________________。
②700℃时,在压强为P2时,假设容器为1L,则在该条件平衡常数的数值为______(最简分数形式)
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
(15分)甲醇是基本有机化工原料。甲醇及其可制得产品的沸点如下。
(1)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得二甲胺。二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl ,溶液中各离子浓度由大到小的顺序为 。
(2)甲醇合成二甲基甲酰胺的化学方程式为:
若该反应在常温下能自发进行,则△H 0 (填“ > ”、“ < ”或“ = " )。
(3)甲醇制甲醚的化学方程式为:2CH3OH CH3OCH3+H2O △H。一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应。
CH3OCH3+H2O △H。一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应。
①x/y= 。
②已知387℃时该反应的化学平衡常数K=4。若起始时向容器I中充入0.1 mol CH3OH、0.15 mol CH3OCH3和0.10 mol H2O,则反应将向 (填“正”或“逆”)反应方向进行。
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为 。
(4)以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如下图所示。
电源负极为 (填“A”或“B"),写出阳极的电极反应式 。
若参加反应的O2为 1.12m 3(标准状况),则制得碳酸二甲酯的质量为 kg。
目前“低碳经济”正成为科学家研究的主要课题。请回答下列问题:
I.甲烷自热重整是一种先进的制氢方法,其反应方程式为:
CH4(g) + H2O(g)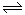 CO(g) + 3H2(g)
CO(g) + 3H2(g)
(1)阅读下图,计算该反应的反应热ΔH = __________kJ/mol。
II.用CH4或其他有机物、O2为原料可设计成燃料电池。
(2)以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为______________________________________________________________________。
(3)以CH4、O2为原料,100 mL 0.15 mol/L NaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448 mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中溶质的成分及物质的量之比为____________________,各离子浓度由大到小的顺序为______________________________。
III.利用I2O5消除CO污染的反应为:5CO(g) + I2O5(s)  5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答:
5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答: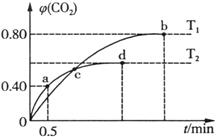
(4)T2时,0 ~ 0.5 min内的反应速率v(CO) = ____________________。
(5)T1时化学平衡常数K = ____________________。
(6)下列说法不正确的是___________(填字母序号)。
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的压强相等 |
| C.d点时,增大体系压强,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb < Kd |
试题篮
()