反应mA(s)+nB(g)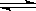 pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
①m+n>p ②x点表示的正反应速率大于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大
| A.①②⑤ | B.只有②④ | C.只有①③ | D.①③⑤ |
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=____mol/L,反应开始前容器中的A、B的物质的量:n(A)= n(B)=______mol;
(2)B的平均反应速率v(B)=________mol/(L·min);
(3)x的值为________。
已知2NO2(g) N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。
请回答:
(1)A中的现象 ,B中的现象 ;
(2)由此可知,降低温度,该化学平衡向 (填“正”或“逆”)反应方向移动;
(3)该化学反应的浓度平衡常数表达式为 ,升高温度,该反应中NO2的转化率将 (填“增大”、“减小”或“不变”)。
Ⅱ.在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
①推进针筒后颜色变深的原因是 ;
②一段时间后气体颜色又变浅的原因是 ;
③由此实验得出的结论是 。
(2)将第三支针筒活塞拉至20cm3处,该同学观察到的现象是 ;在此过程中,该反应的化学平衡常数将 (填“增大”、“减小”或“不变”,下同),NO2的转化率将 。
(8分)氨的合成是最重要的化工生产之一。
(1)工业上可用甲烷与水反应得到合成氨用的H2:其热化学反应方程式为CH4(g)+H2O(g) CO(g)+3H2(g) △H4,已知有关反应的能量变化如下图所示:
CO(g)+3H2(g) △H4,已知有关反应的能量变化如下图所示:
则△H4=______________(用a、b、c表示)
(2)在2个恒压的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g) 2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
| 达到平衡的时间(min) |
t |
5 |
| 平衡时N2的浓度(mol·L-1) |
3 |
c |
①甲容器达到平衡所需要的时间t 5min(填“>”、“<” 或“=”,下同);乙容器达到平衡时N2的浓度c 3 mol·L-1。
②下图中虚线为该反应在使用催化剂条件下,关于起始N2与H2投料比和 H2平衡转化率的关系图。当其他条件完全相同时,用实线画出不使用催化剂情况下H2平衡转化率的示意图。
(8分)碳的化合物与人类生产、生活密切相关。
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO(g)和H2O(g),t℃时测得部分数据如下表。
| T/min |
0 |
1 |
2 |
3 |
4 |
| n(H2O)/mol |
1 |
0.8 |
0.65 |
0.6 |
0.6 |
| n(CO)/mol |
0.8 |
0.6 |
0.45 |
0.4 |
0.4 |
则该温度下反应的平衡常数K=________。
(2)相同温度下,若向该容器中充入l molCO、x molH2O(g)、y molCO2、2 molH2,此时v(正)=v(逆),则x、y的关系式是________________。
II.在一恒温、恒容密闭容器中发生反应:
Ni(s)+4CO(g) Ni(CO)4(g),△H,则△H_____0,(填“>”、“<”);缩小容器容积,平衡向_______(填“左”或“右”)移动,△H_______(填“增大”、“减少”或“不变”,下同),混合气体的密度_________。
Ni(CO)4(g),△H,则△H_____0,(填“>”、“<”);缩小容器容积,平衡向_______(填“左”或“右”)移动,△H_______(填“增大”、“减少”或“不变”,下同),混合气体的密度_________。
T℃时,反应物和生成物均为气体的某反应,反应过程中浓度变化如图(Ⅰ)所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是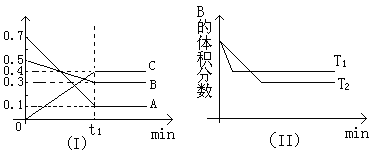
A.在t1时间内用B表示该反应的平均速率为:0.6mol·L-1·mim-1
B.在(t1+10)时,保持其他条件不变,增大压强,平衡向逆反应方向移动
C.T时,在相同容器中,若由0.1mol·L-1A、0.3mol·L-1B和0.4mol·L-1C反应,达到平衡后,C的浓度仍为0.4mol·L-1
D.在其他条件不变时,升高温度,正、逆反应速率均增大,且A的转化率增大
(每空2分,共12分) 在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)A点处,v(正)_______v(逆),A点正反应速率_______B点正反应速率(用“大于”、“小于”或“等于”填空)。
(2)图中表示O2变化的曲线是______。用NO2表示从0~2 s内该反应的平均速率v=____________。
(3)能说明该反应已经达到平衡状态的是______。
a.容器内压强保持不变 b.v(NO)=2v(O2)
c.容器内的密度保持不变 d.v逆(NO2)=2v正(O2)
(4)能使该反应的反应速率增大的是______。
a.适当升高温度 b.及时分离出NO2气体
c.增大O2的浓度 d.选择高效的催化剂
在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)800℃,反应达到平衡时,NO的物质的量浓度是________。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1一种工业合成氨的简易流程图如下:
(1)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 (填“变大”、“变小”或“不变”) 。
2NH3(g)(正反应为放热反应),当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 (填“变大”、“变小”或“不变”) 。
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: _________________。
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是________。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若a mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得到1.14a mol CO、CO2和H2的混合气体,则CO转化率为__________________。
上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)______。
简述本流程中提高合成氨原料总转化率的方法: 。
(9分)一定温度下10L密闭容器中发生某可逆反应,其平衡常数表达式为: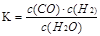
根据题意完成下列填空。
(1)写出该反应的化学方程式: ;若温度升高,K增大,该反应是 (选填“吸热”或“放热”)反应。
(2)下列能判断该反应一定达到平衡状态的是 (选填编号)。
a.v正(H2O)=v逆(H2)
b.容器中气体的密度不随时间改变
c.消耗n mol H2同时消耗n mol CO
d.容器中物质的总物质的量不随时间改变
(3)该反应的v正 随时间变化的关系如图。t2时刻改变了某种条件,改变的条件可能是 或 。
(4)实验测得t2时刻容器内有1molH2O,5min后H2O的物质的量是0.8mol。则这5min内H2O的平均反应速率为 。
(8分)氨的合成是最重要的化工生产之一。
(1)工业上可用甲烷与水反应得到合成氨用的H2:其热化学反应方程式为
CH4(g)+H2O(g) CO(g)+3H2(g) △H4,已知有关反应的能量变化如下图所示:
CO(g)+3H2(g) △H4,已知有关反应的能量变化如下图所示:
则△H4=______________(用a、b、c表示)
(2)在2个恒压的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g) 2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
| 达到平衡的时间(min) |
t |
5 |
| 平衡时N2的浓度(mol·L-1) |
3 |
c |
①甲容器达到平衡所需要的时间t 5min(填“>”、“<”或“=”,下同);乙容器达到平衡时N2的浓度c 3 mol·L-1。
②下图中虚线为该反应在使用催化剂条件下,关于起始N2与H2投料比和H2平衡转化率的关系图。当其他条件完全相同时,用实线画出不使用催化剂情况下H2平衡转化率的示意图。
(8分)碳的化合物与人类生产、生活密切相关。
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO(g)和H2O(g),t℃时测得部分数据如下表。
| T/min |
0 |
1 |
2 |
3 |
4 |
| n(H2O)/mol |
1 |
0.8 |
0.65 |
0.6 |
0.6 |
| n(CO)/mol |
0.8 |
0.6 |
0.45 |
0.4 |
0.4 |
则该温度下反应的平衡常数K=________。
(2)相同温度下,若向该容器中充入l molCO、x molH2O(g)、y molCO2、2 molH2,此时v(正)=v(逆),则x、y的关系式是________________。
II.在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g) Ni(CO)4(g),△H
Ni(CO)4(g),△H
则△H_____0,(填“>”、“<”);缩小容器容积,平衡向_______(填“左”或“右”)移动,△H________(填“增大”、“减少”或“不变”,下同),混合气体的密度_________。
已知在容积固定的密闭容器中充入NH3和O2发生如下反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
(1)下列能说明该反应已经达到平衡状态的是 ;
A.容器中气体总质量不变
B.c(O2)不变
C.υ(O2)=1.25υ(NH3)
D.体系压强不变
E.相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
(2)向该容器中加入正催化剂,则反应速率 (选填“增大”、“减小”、“不变”,下同),降低容器的温度则反应速率 ,通入Ar,则反应速率 。
(3)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小,其原因是 。
A.反应体系温度先升高后降低,所以反应速率是先增大后减小
B.反应物浓度先升高后降低,所以反应速率先增大后减小
C.该反应为放热反应,在反应开始阶段,主要受体系温度升高的影响,反应速率增大;在反应后阶段,主要受浓度减小因素的影响,反应速率减慢
从能量的变化和反应的快慢等角度研究反应:2H2+O2=2H2O。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂 B适当提高氧气的浓度
C.适当提高反应的温度 D.适当降低反应的温度
(2)下图能正确表示该反应中能量变化的是________。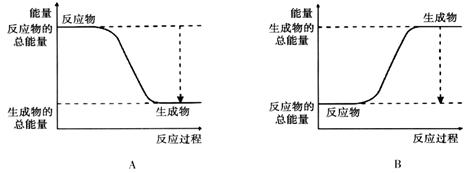
(3)从断键和成键的角度分析上述反应中能量的变化。
| 化学键 |
H—H |
O=O |
H—O |
| 键能kJ/mol |
436 |
496 |
463 |
请填写下表:
| 化学键 |
填“吸收热量”或“放出热量” |
能量变化kJ |
|
| 拆开化学键 |
2molH2和1molO2中的化学键 |
|
|
| 形成化学键 |
4molH—O键 |
|
|
| 总能量变化 |
|
|
(4)氢氧燃料电池的总反应方程式为2H2+O2=2H2O。其中,氢气在________极发生________反应。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
(1)T℃时在2L的密闭容器中,N2、H2混合气体充分反应5min后放出热量46.2 kJ,用H2表示的平均速率为 。
(2)合成氨厂可用反应CO(g)+H2O(g) H2(g)+CO2(g)获得H2,已知该反应的平衡常数随温度的变化如下表,试回答下列问题:
H2(g)+CO2(g)获得H2,已知该反应的平衡常数随温度的变化如下表,试回答下列问题:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
①在800℃发生上述反应,向恒容反应器投入CO2、H2、CO、H2O的物质的量分别为:1 mol、1 mol、2 mol、2 mol,此时该反应由 反应方向开始建立平衡。(选填“正”或“逆”)。
②在500℃时进行上述反应,若CO、H2O的起始浓度均为0.020 mol·L-1,在该条件下,CO的最大转化率为 。
③在其他条件不变的前提下,下列措施一定可以提高H2的百分含量的有___________;
a.增加CO的用量 b.增加H2O(g)的用量
c.增大压强 d.降低温度
试题篮
()