关于平衡常数,下列说法不正确的是( )
| A.平衡常数不随反应物或生成物的浓度的改变而改变 |
| B.平衡常数随温度的改变而改变 |
| C.平衡常数不随压强的改变而改变 |
| D.使用催化剂能使平衡常数增大 |
将1 mol SO2和1 mol O2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2SO2(g)+O2(g) 2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量( )
2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量( )
| A.等于0.3 mol | B.等于0.15 mol |
| C.小于0.15 mol | D.大于0.15 mol,小于0.3 mol |
下列表述中正确的是 ( )
| A.任何能使熵值增大的过程都能自发进行 |
B.已知热化学方程式2SO2(g)+O2(g) 2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则 2SO3(g)ΔH=-Q kJ·mol-1(Q>0),则将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量 |
| C.化学平衡发生移动,平衡常数一定发生变化 |
| D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应,后者比前者放出的热量多 |
对可逆反应2SO2+O2 2SO3,下列叙述正确的是( )
2SO3,下列叙述正确的是( )
| A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(SO2)∶n(O2)=2∶1 |
| B.反应达到平衡后,缩小容器体积,正反应速率加快,逆反应速率减慢,平衡正向移动 |
| C.反应达到平衡后,再加入催化剂,平衡不移动,反应速率不再加快 |
| D.当v正(SO2)∶v正(SO3)=1∶1时,说明该化学反应已经达到平衡 |
密闭容器中的平衡体系H2+I2(g)  2HI(g) △H < O,欲使HI浓度增大,可采取的措施是
2HI(g) △H < O,欲使HI浓度增大,可采取的措施是
| A.扩大体积 | B.升温 | C.降温 | D.加催化剂 |
对于可逆反应:2SO2(g)+O2(g) 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
| A.增大压强 | B.升高温度 |
| C.使用催化剂 | D.多充O2 |
可逆反应H2(g) + I2(g)  2HI(g)达到平衡的标志是
2HI(g)达到平衡的标志是
| A.H2、I2、HI的浓度相等 | B.H2、I2、HI的浓度保持不变 |
| C.混合气体的密度保持不变 | D.混合气体的质量不再改变 |
对于可逆反应C(s)+H2O(g) CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式正确的是 ( )
CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式正确的是 ( )
A.K=[c(C)·c(H2O)]/[c(CO)·c(H2)] B.K=[c(CO)·c(H2)]/[c(C)·c(H2O)]
C.K=[c(H2O)]/[c(CO)·c(H2)] D.K=[c(CO)·c(H2)/[c(H2O)]]
反应X(g)+Y(g)  2Z(g) ΔH<0,达到平衡时,下列说法正确的是
2Z(g) ΔH<0,达到平衡时,下列说法正确的是
| A.减小容器体积,平衡向右移动 | B.加入催化剂,Z的产率增大 |
| C.增大c(X),X的转化率增大 | D.降低温度,Y的转化率增大 |
下图是关于反应A2(g)+3B2(g)  2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是
2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是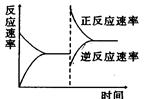
| A.升高温度,同时加压 |
| B.降低温度,同时减压 |
| C.增大反应物浓度,同时使用适宜的催化剂 |
| D.增大反应物浓度,同时减小生成物浓度 |
可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的( )
| A.3v正(N2)=v正(H2) | B.v正(N2)=v逆(NH3) |
| C.2v正(H2)=3v逆(NH3) | D.v正(N2)=3v逆(H2) |
关于平衡常数,下列说法不正确的是( )
| A.平衡常数不随反应物或生成物的浓度的改变而改变 |
| B.平衡常数随温度的改变而改变 |
| C.平衡常数随压强的改变而改变 |
| D.使用催化剂不能使平衡常数增大 |
试题篮
()