在新制的氯水中加入少量的碳酸钠粉末,下列说法正确的是( )
| A.pH增大,HClO浓度增大 | B.pH减小,Cl-浓度增大 |
| C.pH增大,Cl-浓度减小 | D.pH减小,HClO浓度减小 |
化学平衡常数(K)、电离常数(Ka)、溶度积常数(Ksp)是判断物质性质或变化的重要的常数。下列关于这些常数的说法中,正确的是( )
| A.化学平衡常数的大小与温度、浓度、压强、催化剂有关 |
| B.CH3COONH4溶液几乎呈中性,说明Ka(CH3COOH)与Kb(NH3·H2O)近似相等 |
| C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-=AgI(s)+Cl-能够发生 |
| D.Ka(HCN)<Ka(CH3COOH),说明相同浓度时,氢氰酸的酸性比醋酸强 |
将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为
b L(气体体积均在同温同压下测定),该b L气体中NH3的体积分数是( )
A. ×100% ×100% |
B. ×100% ×100% |
C. ×100% ×100% |
D. ×100% ×100% |
当其他条件不变时,下列说法正确的是
| A.使用催化剂一定能加快反应速率 |
| B.用粉末状锌代替块状锌与稀硫酸反应一定会加快反应速率 |
| C.当反应物与生成物浓度相等时,可逆反应一定已达到化学平衡状态 |
| D.在合成氨反应中,增大N2浓度一定可以使H2的转化率达到100% |
一定条件下,可逆反应2A B+3C,在下列四种状态中,处于平衡状态的是( )。
B+3C,在下列四种状态中,处于平衡状态的是( )。
| |
正反应速率 |
逆反应速率 |
| A |
vA=2 mol·L-1·min-1 |
vB=2 mol·L-1·min-1 |
| B |
vA=2 mol·L-1·min-1 |
vC=2 mol·L-1·min-1 |
| C |
vA=1 mol·L-1·min-1 |
vB=2 mol·L-1·min-1 |
| D |
vA=1 mol·L-1·min-1 |
vC=1.5 mol·L-1·min-1 |
可逆反应达到最大反应限度的本质特征是( )。
| A.反应停止了 | B.正逆反应的速率均为零 |
| C.正逆反应都还在继续进行 | D.正逆反应的速率相等 |
决定化学反应速率的根本因素是
| A.温度和压强 | B.反应物的浓度 |
| C.参加反应的各物质的性质 | D.催化剂的加入 |
可逆反应2SO2 + O2 2SO3达到一定限度后通入18O2,一段时间18O可能存在于( )
2SO3达到一定限度后通入18O2,一段时间18O可能存在于( )
| A.SO3和O2 中 | B.SO3和SO2 中 |
| C.SO3, SO2和O2 中 | D.SO2和O2 中 |
下列原理和定律中,可用于判断化学平衡移动方向的是
| A.盖斯定律 | B.阿伏加德罗定律 | C.勒夏特列原理 | D.质量守恒定律 |
在平衡体系2NO+O2 2NO2中通入18O组成的氧气,重新达到平衡后,则18O
2NO2中通入18O组成的氧气,重新达到平衡后,则18O
| A.只存在于O2中 |
| B.只存在于NO2中 |
| C.只存在于O2和NO2中 |
| D.存在于NO、O2、NO2 |
关于平衡常数,下列说法不正确的是
| A.平衡常数随温度的改变而改变 |
| B.使用催化剂不能改变平衡常数 |
| C.平衡常数不随反应物或生成物浓度的改变而改变 |
| D.增大压强促使平衡向正反应方向进行,则平衡常数增大 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数值为1600
2Z,其平衡常数值为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
可逆反应2NO2 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2,NO,O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B.②③⑤⑦ | C.①③④⑤ | D.全部 |
COCl2(g) 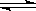 CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g);ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
| A.①②④ | B.①④⑥ |
| C.②③⑤ | D.③⑤⑥ |
试题篮
()