下列不能用勒夏特列原理解释的是
| A.Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B.棕红色NO2加压后颜色先变深后变浅 |
| C.H2、I2、HI平衡混和气加压后颜色变深 |
| D.打开啤酒瓶盖,瓶口冒出大量气泡 |
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s) ΔH>0下列叙述正确的是
Z(g)+W(s) ΔH>0下列叙述正确的是
| A.加入少量W,逆反应速率增大 |
| B.升高温度,平衡逆向移动 |
| C.当容器中气体压强不变时,反应达到平衡 |
| D.平衡后加入X,上述反应的ΔH增大 |
在一定温度下的定容密闭容器中,发生反应A(s)+2B(g) C(g)+D(g),当下列物理量不再变化时,表明反应已达平衡的是 ( )
C(g)+D(g),当下列物理量不再变化时,表明反应已达平衡的是 ( )
①混合气体的压强 ②混合气体的密度③混合气体的平均相对分子质量④气体总物质的量
| A.①② | B.②③ | C.② | D.③ |
常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是 ( )
A.H2A的电离方程式为H2A===H++HA-,HA-  H++A2-
H++A2-
B.pH=4的NaHA水溶液中离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合液离子浓度大小为c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-)
D.Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+)
已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11,Ksp[Fe(OH)3]=8.0×10﹣38,Kb(NH3·H2O)=1.8×10﹣5,下列叙述中不正确的是( )
| A.25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀 |
| B.25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂 |
| C.25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强 |
D.25℃时,NH4++H2O NH3·H2O+H+的平衡常数为5.6×10﹣10 NH3·H2O+H+的平衡常数为5.6×10﹣10 |
下列关于化学平衡常数的说法,
| A.在任何条件下,化学平衡常数都是一个定值. |
| B.改变浓度,平衡常数会变 |
| C.同条件下,平衡常数只与温度有关. |
| D.化学平衡发生移动,平衡常数必定发生改变. |
在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g) + nB(g) ⇌pC(g) + qD(g) ,当m、n、p、q为任意整数(不为零)时,不能说明达到平衡状态的标志是
| A.D的质量不再改变 |
| B.各组分的浓度不再改变 |
| C.反应速率υA:υB:υC:υD=m:n:p:q |
| D.单位时间内m mol A断键发生反应,同时p mol C也断键发生反应 |
已知H2(g)+I2(g)  2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
| A.甲中充入HI气体,乙中不变 | B.甲降低温度,乙增大压强 |
| C.甲中加入0.1 mol He,乙中不变 | D.甲增加0.1 mol H2,乙增加0.1 mol I2 |
在容积不变的密闭容器中,一定条件下发生反应:2A ⇌B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是
| A.升高温度,正反应速率增大,逆反应速率减小 |
| B.若正反应是放热反应,则A为气态 |
| C.若向容器中充入惰性气体,则平衡向右移动 |
| D.物质A一定为非气态,且正反应是吸热反应 |
在2000K时,反应CO(g)+1/2O2(g)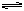 CO2(g)的平衡常数为K1,则相同温度下反
CO2(g)的平衡常数为K1,则相同温度下反
应2CO2(g)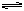 2CO(g)+O2(g)的平衡常数K2为( )
2CO(g)+O2(g)的平衡常数K2为( )
| A.1/K12 | B.K12 | C.1/K1 | D.K1-1/2 |
已知反应:2NO2(g)+4CO(g) N2(g)+4CO2(g) ΔH<0。将一定量的NO2与CO充入装有催化剂的注射器中后封口。右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法不正确的是
N2(g)+4CO2(g) ΔH<0。将一定量的NO2与CO充入装有催化剂的注射器中后封口。右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法不正确的是
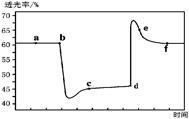
| A.b点的操作是快速压缩注射器 |
| B.c点与a点相比,c(NO2)、c(N2)都增大 |
C.e点: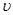 (正) < (正) <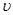 (逆) (逆) |
| D.若考虑体系温度变化,且没有能量损失,则平衡常数K(c) >K(f) |
一定温度下,反应2SO2+O2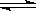 2SO3,达到平衡时,n (SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)="0.8" mol,n(SO3)="1.4" mol,此时SO2的物质的量应是
2SO3,达到平衡时,n (SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)="0.8" mol,n(SO3)="1.4" mol,此时SO2的物质的量应是
| A.1.2 mol | B.0.8 mol | C.0.6 mol | D.0.4 mol |
下列变化不能用勒夏特列原理解释的是
| A.红棕色的NO2气体加压后颜色先变深再变浅 |
| B.H2、I2、HI混合气体加压后颜色变深 |
| C.二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 |
| D.打开汽水瓶,看到有大量的气泡逸出 |
试题篮
()