在恒温、恒容的条件下,有反应2A(g)+2B(g) C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度分别为2 mol/L和6mol/L。则以下叙述正确的是
C(g)+3D(g),现从两条途径分别建立平衡。途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度分别为2 mol/L和6mol/L。则以下叙述正确的是
A.两途径最终达到平衡时,体系内混合气的压强相同
B.两途径最终达到平衡时,体系内混合气的百分组成不同
C.达平衡时,途径Ⅰ的反应速率v(A)等于途径Ⅱ的反应速率v(A)
D.达平衡时,途径Ⅰ所得混合气的密度为途径Ⅱ所得混合气密度的1/2
化学中常用图象直观地描述化学反应的进程或结果(图④纵坐标表示难溶物达到饱和时的浓度)。下列对图象描述正确的是
A.根据图①可判断可逆反应A2(g) +3B2(g) 2AB3(g)的△H>0 2AB3(g)的△H>0 |
B.图②可表示压强对可逆反应2A(g) +2B(g) 3C (g) + D(s)的影响,乙的压强大 3C (g) + D(s)的影响,乙的压强大 |
| C.图③可表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 |
D.根据图④,若除去CuSO4溶液中的 Fe3+可采用向溶液中加入适量CuO,至pH在4左右 Fe3+可采用向溶液中加入适量CuO,至pH在4左右 |
图甲、乙分别表示反应CO2(g)+H2(g)  CO(g)+H2O(g),ΔH>0 在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是
CO(g)+H2O(g),ΔH>0 在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是
| A.图甲中t2时刻发生改变的条件是增大反应物的浓度 |
| B.图甲中t2时刻发生改变的条件是增大压强 |
| C.图乙中t2时刻发生改变的条件是升高温度 |
| D.图乙中t2时刻发生改变的条件是从体系中分离出水蒸气 |
某温度下, 的平衡常数
的平衡常数 .该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是
.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是
| A.平衡时,乙中CO2的转化率大于60% |
| B.平衡时,甲中和丙中H2的转化率均是60% |
| C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L |
| D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
下列说法正确的是
① pH=2和pH=1的HNO3中c(H+)之比为1∶10
②Na2CO3溶液中c(Na+)与c(CO32-)之比为2∶1
③同温时,pH=10的KOH溶液和pH=10的KCN溶液中由水电离的OH-浓度后者大
④分别向100 mL 0.1 mol·L-1的醋酸和10 mL 1.0 mol·L-1的醋酸中加入KOH,恰好中和所需的KOH一样多
| A.①④ | B.①③④ | C.①② | D.①②③ |
一定温度下,在容积不变的密闭容器中发生反应:2NO2(g)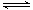 2NO(g)+ O2(g),能说明该反应已达化学平衡状态的是
2NO(g)+ O2(g),能说明该反应已达化学平衡状态的是
①生成n mol O2的同时生成2n mol NO2
②生成n mol O2的同时生成2n mol NO
③容器内气体的压强不再改变 ④混合气体的颜色不再改变
⑤混合气体的密度不再改变
| A.①②④ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
在一定温度下,容器内某一反应中M、N两种气体的物质的量随反应时间变化的曲线如图,下列表述中正确的是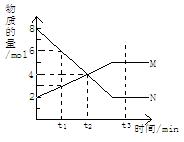
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
已建立化学平衡的某可逆反应,当改变某反应条件使平衡向正反应方向移动时,下列有关叙述正确的是
| A.正反应速率一定增大 | B.生成物的质量分数一定增大 |
| C.逆反应速率一定减小 | D.至少有一种反应物的转化率增大 |
在一定温度下,反应A2(g) + B2(g)  2AB(g) 达到平衡状态的标志是
2AB(g) 达到平衡状态的标志是
| A.单位时间内生成n molA2,同时生成n mol的AB |
| B.容器内总压强不随时间而变化 |
| C.单位时间内生成2n mol AB ,同时生成n mol 的B2 |
| D.单位时间内生成n molA2,同时生成n mol的B2 |
将m mol A 与n mol B 充入一密闭容器中,发生反应如下:m A(g) + n B(g) p C(g);△H = a kJ/mol ( a<0);若在恒温、恒容下达到平衡时A的转化率为A1% ;在绝热、恒容条件下达到平衡时A的转化率为A2%,则A1和A2的关系为
p C(g);△H = a kJ/mol ( a<0);若在恒温、恒容下达到平衡时A的转化率为A1% ;在绝热、恒容条件下达到平衡时A的转化率为A2%,则A1和A2的关系为
| A.A1<A2 | B.A1=A2 |
| C.A1>A2 | D.不能确定 |
可逆反应: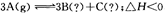 ,下列分析一定正确的是
,下列分析一定正确的是
A.若升高温度气体的平均相对分子质量减小,则B、C一定都为气体
B.若B为气体,C为非气体,则平衡后向恒容密闭容器中补充A,再次建立平衡时气体的平均相对分子质量减小
C.若B、C均为气体,则平衡后将压强增大一倍,再次建立平衡时A的浓度是原平衡状态的两倍
D.若改变某一条件,使该平衡状态发生移动,再次建立平衡时,A的体积分数下降则改变的条件一定是升温
一定温度下,可逆反应:A2(气)+B2(气)  2AB(气),达到限度的标志是
2AB(气),达到限度的标志是
| A.容器的总压强不随时间而变化 |
| B.单位时间内有n mol A2生成的同时有n mol B2生成 |
| C.单位时间内有n mol B2发生反应的同时有n mol AB分解 |
| D.单位时间内生成n mol A2同时就有2n mol AB生成 |
反应3H2(g) + N2(g) 2NH3(g) ΔH = -46.19 kJ. mol—1,关于这个反应的平衡常数K,下列说法正确的是( )
2NH3(g) ΔH = -46.19 kJ. mol—1,关于这个反应的平衡常数K,下列说法正确的是( )
| A.随温度升高K增加 | B.随压强升高K增加 |
| C.随温度升高K减小 | D.随压强升高K减小 |
试题篮
()