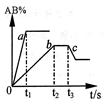
| A.A2 、B2 、AB 均为气体,正反应放热 |
| B.AB 为气体,A2 、B2中最少有一种为非气体,正反应放热 |
| C. AB 为气体,A2 、B2中:最少有一种为非气体,正反应吸热 |
| D.AB 为固体,A2 、B2中最少有一种为气体,正反应吸热 |
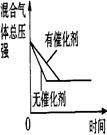
在一体积不变的密闭容器中发生如下化学反应:2A(g) B(g)+C(g)。当物质A的起始浓度为1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:
B(g)+C(g)。当物质A的起始浓度为1.0 mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下列各图所示:
 |
下列有关说法中正确的是
A.条件I、条件II时的反应温度不同,压强相同
B.条件I时可能未使用催化剂,条件II时可能使用了催化剂
C.条件III时的平衡混合物中,物质C的浓度等于0.6 mol·L-1
D.条件IV和条件II相比较,条件IV时可能增大了反应体系的压强
在温度恒定时,在1L密闭容器中存在着H2、I2、HI三种物质,下列图象均是表示此反应的有关量值与时间或外界条件时关系的,下列有关叙述错误的是 ( )
| A.图①中,t0时三种物质的物质的量相等 |
| B.图②中逆反应为H2+I2→2HI |
| C.图③中t2改变条件后容积内各成分百分含量均会发生变化 |
| D.图④表明HI起始数量的不同,不会改变平衡体系的各成份百分含量 |
 2Z
2Z
| A.平衡常数K值越大,X的转化率越大 |
| B.达到平衡时,反应速率v正(X)==2v逆(Y) |
| C.达到平衡后,降低温度,正向反应速率减小的倍数小于逆向反应速率减小的倍数 |
| D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方法移动 |
在密闭容器中,发生反应H2 (g)+ I2 (g)  2HI(g),通入xmol H2和ymol I2 蒸气,当x=2,y=1时在一密闭容器中某温度条件下反应达到平衡时碘的转化率为10%,,则该温度条件下平衡常数K= 。
2HI(g),通入xmol H2和ymol I2 蒸气,当x=2,y=1时在一密闭容器中某温度条件下反应达到平衡时碘的转化率为10%,,则该温度条件下平衡常数K= 。
对于可逆反应N2(g)+3H2(g)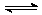 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是
| |
A |
B |
C |
D |
| 研究目的 |
压强对反应的影响(P2>P1) |
温度对反应的影响 |
平衡体系增加N2对反应的影响 |
催化剂对反应的影响 |
| 图示 |
 |
 |
 |
 |
已知反应mX(g)+nY(g) qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
| A.X的正反应速率是Y的逆反应速率的m/n倍 |
| B.通入稀有气体He使体系压强增大,平衡将正向移动 |
| C.降低温度,混合气体的平均相对分子质量变小 |
| D.增加X的物质的量,Y的转化率降低 |
在容积为VK的密闭容器中发生2NO2 2NO+O2的反应。反应过程中NO2的物质的量 随时间变化的状况如图所示。
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是( )
A.有、无催化剂B.温度不同C.压强不同D.V值不同
(2)写出该反应的化学平衡常数K的表达式 ,并比较K800℃ K850℃(填>、<或=)。
(3)在图上作出在A条件下NO的变化曲线,并求算在B条件下从反应开始至达到平衡,氧气的反应速率VO2= 。
(4)不能说明该反应已达到平衡状态的是 ( )
A.V正(NO2)=V逆(NO) B.C(NO2)=C(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
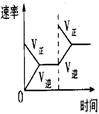
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是
2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是
| A.t1时升高了温度 | B.t3时加入了催化剂 |
| C.t5~t6时刻,Y转化率最小 | D.在t3~t4时间内,X的体积分数最大 |
工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
| A.SO2的转化率为30% |
| B.反应共放出了196.6 kJ的热量 |
| C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1 |
| D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同 |
竖炉冶铁工艺流程如图,使天然气产生部分氧化,并在特殊的燃烧器中使氧气和天然气燃烧CH4(g)+2O2(g)=CO2(g)+2H2O(g),催化反应室发生的反应为:CH4(g)+H2O(g)  CO(g)+3H2(g);△H1=+216kJ/mol;CH4(g)+ CO2(g)
CO(g)+3H2(g);△H1=+216kJ/mol;CH4(g)+ CO2(g) 2CO(g) + 2H2(g); △H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是
2CO(g) + 2H2(g); △H2=+260kJ/mol(不考虑其他平衡的存在),下列说法正确的是
| A.增大催化反应室的压强,甲烷的转化率减小 |
| B.催化室需维持在550~750℃,目的仅是提高CH4转化的速率 |
| C.设置燃烧室的主要目的是产生CO2和水蒸气作原料气与甲烷反应 |
| D.若催化反应室中,达到平衡时,容器中n(CH4)=amol,n(CO)=bmol |
n(H2)=cmol,则通入催化反应室的CH4的物质的量为a+(b+c)/4
已知2SO2(g)+ O2(g) 2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2 和1molSO3、1molSO2、0.5mol O2,当它们分别达到平衡时放出的热量为Q1 KJ和Q2KJ,则下列比较正确的是( )
2SO3(g);△H=-197kJ/mol,同温下,往相同体积的密闭容器甲、乙中分别充入2molSO2、1molO2 和1molSO3、1molSO2、0.5mol O2,当它们分别达到平衡时放出的热量为Q1 KJ和Q2KJ,则下列比较正确的是( )
| A.Q2=" 1/2" Q1="98.5" | B.Q2="1/2" Q1<98.5 | C.Q2<1/2 Q1<98.5 | D.1/2 Q1< Q2 <98.5 |
在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g) 2Z(g),并达平衡,以Y的浓度改变表示的反应速度与时间t的关系如图所示,则Y的平衡浓度表达式正确的是(式中S是对应区域的面积)( )
2Z(g),并达平衡,以Y的浓度改变表示的反应速度与时间t的关系如图所示,则Y的平衡浓度表达式正确的是(式中S是对应区域的面积)( )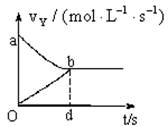
| A. 2-Saob | B.1-Saob | C.2-Sabdo | D.1-Sbod |
试题篮
()