CO(g)+H2O(g) CO2(g)+H2(g)△H<0在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)△H<0在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
| A.c2(CO)<c2(H2O) | B.c1(CO)>c2(CO) | C.K2和K1的单位均为mol/L | D.K2<K1 |
一定温度下,容积不变的密闭容器中,充入一定量HI气体,发生如下可逆反应:2HI(g) H2(g)+I2(g);△H>0。下列说法正确是
H2(g)+I2(g);△H>0。下列说法正确是
| A.若每消耗2n mol HI的同时生成n mol H2,表明该反应已达平衡 |
| B.容器内的压强不发生变化,表明该反应已达平衡 |
| C.平衡时,其它条件不变,再充入一定量HI,重新达平衡后;I2的百分含量增大 |
| D.平衡时,其它条件不变,升高温度,混合气体的颜色加深 |
已知:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是
CH3OH(g) + H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是
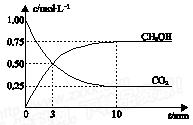
A.升高温度能使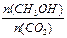 增大 增大 |
| B.反应达到平衡状态时,CO2的平衡转化率为75% |
| C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1 |
FeCl3+3NH4SCN Fe(SCN)3+3NH4Cl
Fe(SCN)3+3NH4Cl
所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
| A.向溶液中加入少量KCl晶体 |
| B.向溶液中加入少量的水 |
| C.向溶液中加入少量无水硫酸铜,变蓝后立即取出 |
| D.向溶液中滴加2滴1 mol·L-1的FeCl3(aq) |
aA(g) bB(g)
bB(g)
达平衡后,保持温度不变,将容器容积增加一倍,新平衡建立时,cB是原来的 60%,则( )
| A.平衡向正反应方向发生了移动 | B.A 物质的转化率变小了 |
| C.B 物质的质量分数增大了 | D.a>b |
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
这是工业合成尿素的反应。如果将容器的容积缩小为原来的 1/3,则达到平衡时(平衡 B)下列说法一定正确的是( )
A.气体的平均式量比原来大 B.气体的平均式量比原来小
C.气体的平均式量与原来相等 D.依据题给条件无法确定
可逆反应aA(?)+2 B(g) 2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( ) 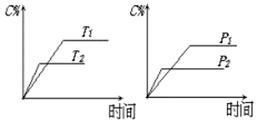
| A.达到平衡后,加入催化剂则C%增大 |
| B.达到平衡后,若升高温度,平衡向右移动 |
| C.a可以为任意的正整数 |
| D.达平衡后,增加A的量,有利于平衡向右移动 |
将3molA与2.5molB混合起来,充入2L的密闭容器中,使之发生反应 3A(气)+ B(气) xC(气)+2D(气)。经过5 min反应达到平衡,生成1mol D,经测定知C的平均反应速率为0.1mol/L(L·min)。与此有关的以下叙述中错误的是
xC(气)+2D(气)。经过5 min反应达到平衡,生成1mol D,经测定知C的平均反应速率为0.1mol/L(L·min)。与此有关的以下叙述中错误的是
| A.A的平均反应速率为0.15mol/(L·min) |
| B.B的转化率为20% |
| C.B的平衡浓度为0.5mol/L |
| D.x的数值为2 |
在某体积可变的密闭容器里盛有适量的A和B的混合气体,在一定条件下发生反应:
A+3B 2C
2C
若维持温度和压强不变,当达到平衡时,容器的体积为vL,其中C气体的体积占10%,下列推断正确的是 [ ]
①原混合气体的体积为1.2Vl ②原混合气体的体积为1.1vL ③反应达平衡时气体A消耗掉0.05vL ④反应达平衡时气体B消耗掉0.05vL
| A.① | B.② |
| C.③ | D.④ |
下列说法可以证明反应N2+3H2 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
| A.1molN≡N键断裂的同时,有3molH—H键生成 |
| B.1molN≡N键断裂的同时,有3molH—H键断裂 |
| C.1molN≡N键断裂的同时,有6molH—H键断裂 |
| D.1molN≡N键断裂的同时,有6molH—H键生成 |
下列说法正确的是
| A.条件一定时可逆反应能进行到底 |
| B.可逆反应达到化学平衡状态较快,说明化学反应速率快 |
| C.化学反应中,物质含有的活化分子数目越大,化学反应速率越快 |
| D.可逆反应维持的时间越长,生成物的百分含量必定越高 |
在密闭容器内进行下列反应:X2(g)+Y2(g)  2Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,当反应在一定条件下达到平衡时各物质浓度可能是( )
2Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,当反应在一定条件下达到平衡时各物质浓度可能是( )
| A.Z为0.3mol·L-1 | B.Y2为0.35mol·L-1 |
| C.X2为0.2mol·L-1 | D.Z为0.4mol·L-1 |
反应:2SO2+O2 2SO3在一定条件下的密闭容器中进行。已知反应的某一时间SO2、O2、SO3浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当达到平衡时,可能存在的数据为( )
2SO3在一定条件下的密闭容器中进行。已知反应的某一时间SO2、O2、SO3浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,当达到平衡时,可能存在的数据为( )
| A.SO2为0.4 mol·L-1、O2为0.2 mol·L-1 |
| B.SO2为0.25 mol·L-1 |
| C.SO2、SO3均为0.25 mol·L-1 |
| D.SO3为0.4 mol·L-1 |
一个真空密闭容器中盛有1molPCl5,加热到200℃时发生了反应PCl5(g) PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度下和同样容器中最初投入的是2molPCl5,反应达到平衡时PCl5的分解率为N%,M与N的关系是( )
PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度下和同样容器中最初投入的是2molPCl5,反应达到平衡时PCl5的分解率为N%,M与N的关系是( )
| A.M>N | B.M<N | C.M="N" | D.不能确定 |
试题篮
()