下列四种情况不能用右图图像表示的是( )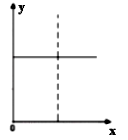
A.N2(g)+3H2(g)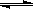 2NH3(g),恒容充入He,N2的转化率与时间的关系 2NH3(g),恒容充入He,N2的转化率与时间的关系 |
B.CH4(g)+H2O(g)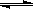 CO(g)+3H2(g);ΔH>0,平衡后CH4的物质的量与 CO(g)+3H2(g);ΔH>0,平衡后CH4的物质的量与△H的关系 |
C.FeCl3+3KSCN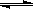 Fe(SCN)3+3KCl,平衡后加入KCl固体,c(Cl—)与正反应速率关系 Fe(SCN)3+3KCl,平衡后加入KCl固体,c(Cl—)与正反应速率关系 |
D.H2(g)+I2(g)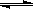 2HI(g),平衡后缩小容器容积,速率与时间的关系 2HI(g),平衡后缩小容器容积,速率与时间的关系 |
硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关接触氧化反应
2SO2 + O2 2SO3的说法中正确的是
2SO3的说法中正确的是
| A.只要选择适宜的条件,SO2和O2就能全部转化为SO3 |
| B.该反应达到平衡后,反应就完全停止了,即正逆反应速率为零 |
| C.若用18O原子组成的O2参加反应,平衡时SO2中也会含有18O |
| D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
有些物质的制备从化学性质的“强制弱”来看似乎难以进行,但利用勒夏特列原理却取得了成功,以下属于这种情况的是
A.NaBr(s)+H3PO4(浓)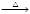 NaH2PO4(aq)+ HBr(g) NaH2PO4(aq)+ HBr(g) |
B.6CaO(l)+2Al(l)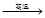 3CaO•Al2O3(s) +3Ca(g) 3CaO•Al2O3(s) +3Ca(g) |
| C.CaCO3(s) +2HCl(aq) →CaCl2(aq) +H2O (l) +CO2(g) |
| D.KICl2(aq)+H2S(aq)→KI (aq)+2HCl (aq) +S(s) |
在一密闭容器中进行如下反应:3H2(气)+N2(气) 2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2NH3(气),已知反应过程中某一时 刻 H2、N2、NH3的浓度分别为 0.3mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
| A.H2为 0.6mol/L、N2为 0. 2mol/L | B.NH3为 0.25mol/L |
| C.N2、NH3均为 0.15mol/L | D.NH3为 0.4mol/L |
可逆反应2SO2 (g)+ O2 (g)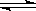 2SO3(g)达到平衡的标志是
2SO3(g)达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.只有③ | D.只有① |
对于反应2CO(g)+ O2(g) 2CO2(g)(ΔH<0),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡向正方向移动的是
2CO2(g)(ΔH<0),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡向正方向移动的是
| A.恒容通入少量He | B.恒容通入少量CO2 |
| C.升高温度 | D.缩小容器体积 |
下列各物质的颜色变化不是由平衡移动引起的是( )
| A.H2、I2、HI平衡混合气体加压颜色变深 |
| B.氯水光照颜色变浅 |
| C.NO2、N2O4混合气体加热颜色变深 |
| D.FeCl3和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
对已经达到化学平衡状态的下列反应2X(g)+Y2(g) Z(g),减小压强时,对反应产生的影响是( )
Z(g),减小压强时,对反应产生的影响是( )
| A.v正、v逆都减小,平衡逆向移动 | B.v正、v逆都增大,平衡正向移动 |
| C.v逆增大,v正减小,平衡逆向移动 | D.v逆减小,v正增大,平衡正向移动 |
下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
| A.实验室配制FeCl3溶液时,应向其中加入少量浓盐酸 |
| B.合成氨工业中使用铁触媒做催化剂 |
| C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 |
| D.热的纯碱溶液去油污效果好 |
一定温度下,将NO2与SO2以体积比为1:2置于密闭容器中发生NO2(g)+SO2(g) SO3(g)+NO(g) △H=" -41.8" kJ•mol-1,测得上述反应平衡时NO2与SO2体积比为1:6,下列说法正确的是( )
SO3(g)+NO(g) △H=" -41.8" kJ•mol-1,测得上述反应平衡时NO2与SO2体积比为1:6,下列说法正确的是( )
| A.平衡常数K=8/3 |
| B.达到平衡后NO2和SO2的转化率相等 |
| C.SO3和NO的体积比保持不变可以证明达到平衡状态 |
| D.每消耗1molSO3的同时生成1molNO2 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强可使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
将固体NH4I置于密闭容器中,在某温度下发生下列反应:NH4I(s)  NH3(g)+HI(g),2HI(g)
NH3(g)+HI(g),2HI(g)  H2(g)+I2(g)。当反应达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则NH3的浓度为
H2(g)+I2(g)。当反应达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则NH3的浓度为
| A.3.5mol·L-1 | B.4mol·L-1 | C.4.5mol·L-1 | D.5mol·L-1 |
2008年1月8日,国家主席胡锦涛在人民大会堂为获得2007年国家最高科学技术奖的石油化工催化剂专家闵恩泽教授颁奖,以表彰他在催化剂研究方面做出的突出贡献。下列关于催化剂的说法正确的是
| A.使用催化剂可以增大正反应速率,减小逆反应速率 |
| B.使用催化剂可以使化学平衡正向移动 |
| C.使用催化剂可以降低反应的活化能 |
| D.使用催化剂可以改变反应的平衡常数 |
已知298 K时,合成氨反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(假定测量过程中没有能量损失):
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(假定测量过程中没有能量损失):
| A.一定大于92.0 kJ | B.无法确定 |
| C.一定小于92.0 kJ/mol | D.一定小于92.0 kJ |
试题篮
()