在一容积可变的密闭容器中进行反应3Fe(s)+4H2O(g) 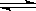 Fe3O4(g)+4H2(g),下列有关叙述正确的是
Fe3O4(g)+4H2(g),下列有关叙述正确的是
| A.增加Fe的量,正反应速率增大 |
| B.将容器的体积缩小一半,正逆反应速率增大 |
| C.保持体积不变,充入Ne,正逆反应速率增大 |
| D.保持压强不变,充入Ne,正逆反应速率不变 |
已知:2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下表,下列说法正确的是
CH3OCH3(g)+H2O(g);ΔH=-25 kJ·mol-1,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下表,下列说法正确的是
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c/(mol·L-1) |
0.8 |
1.24 |
1.24 |
A. 平衡后升高温度,平衡常数>400
B. 平衡时,c(CH3OCH3)=1.6 mol·L-1
C. 平衡时,反应混合物的总能量减少40 kJ
D. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
臭氧的脱硝反应为:2NO2(g)+O3(g) N2O5(g)+O2(g),一定条件下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,一段时间后达到平衡。下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化。下列叙述正确的是
N2O5(g)+O2(g),一定条件下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,一段时间后达到平衡。下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化。下列叙述正确的是
A.反应2NO2(g)+O3(g) N2O5(g)+O2(g) △S<0 N2O5(g)+O2(g) △S<0 |
| B.曲线b对应的条件改变可能是加入了催化剂,平衡常数Ka=Kb |
| C.曲线b对应的条件改变可能是密闭容器的体积变为4.0 L |
| D.若c1=0.3mol·L-1,从反应开始到平衡时该反应的速率v(NO2)=0.005 mol·L-1·s-1 |
向甲乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同条件下,发生下列反应:A(g)+B(g) xC(g);△H<0。测得两容器中C(A)随时间t的变化如图所示。下列说法正确的是( )
xC(g);△H<0。测得两容器中C(A)随时间t的变化如图所示。下列说法正确的是( )
A.x可能等于2也可能等于3
B.向平衡后的乙容器中充入氦气可使C(A)增大
C.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
D.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78mol·L-1<C(A)<1.56mol·L-1
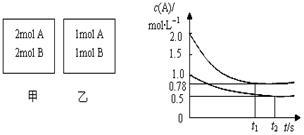
向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的C(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3时刻为使用催化剂。下列说法中正确的是( )

A.若t1=15 s,用A的浓度变化表示t0~t1阶段的平均反应速率为0.004 mol·L-1·s-1
B.t4~t5阶段改变的条件一定为减小压强
C.该容器的容积为2 L,B的起始物质的量为0.02 mol
D.t5~t6阶段,容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式3A(g) B(g)+2C(g)ΔH=-50a kJ·mol-1
B(g)+2C(g)ΔH=-50a kJ·mol-1
一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
| 容器编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
||
| I |
387 |
0.20 |
0.080 |
0.080 |
| Ⅱ |
387 |
0.40 |
|
|
| Ⅲ |
207 |
0.20 |
0.090 |
0.090 |
下列说法正确的是( )
A.该反应的正方应为吸热反应
B.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)⇌SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示.由图可得出的正确结论是( )
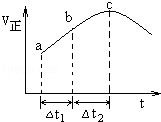
| A.反应在C点达到平衡状态 |
| B.反应物浓度:a点小于B点 |
| C.反应物的总能量低于生成物的总能量 |
| D.△t1=△t2时,SO2的转化率:a~B段小于B~C段 |
反应N2O4(g)  2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是( )
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是( )

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+Cl2(g)= PCl5(g);反应达到平衡时,PCl5为0.4mol;如果此时移走1.0molPCl3和0.5molCl2,在相同的温度下再达到平衡时,PCl5的物质的量为( )
| A.0.4mol |
| B.0.2mol |
| C.小于0.2mol |
| D.大于0.2mol,小于0.4mol |
在某恒容的密闭容器中,可逆反应A(g)+B(g) xC(g)有如图所示的关系曲线,下列说法正确的是
xC(g)有如图所示的关系曲线,下列说法正确的是
| A.温度:T1>T2 | B.压强:p1>p2 |
| C.正反应是放热反应 | D.x的值是2 |
可逆反应2A(g) B(g)(△H<0)从反应开始至建立平衡后改变某一外界条件(外界条件指的是温度、压强、浓度和催化剂)使平衡发生了移动至新的平衡,该过程中各物质的浓度(用c表示)随时间变化情况如下图所示,试分析各图,指出导致平衡移动的因素和平衡移动的方向:
B(g)(△H<0)从反应开始至建立平衡后改变某一外界条件(外界条件指的是温度、压强、浓度和催化剂)使平衡发生了移动至新的平衡,该过程中各物质的浓度(用c表示)随时间变化情况如下图所示,试分析各图,指出导致平衡移动的因素和平衡移动的方向:

平衡移动的因素:①升高温度 ②降低温度 ③增大压强 ④减小压强
⑤减小生成物B的浓度 ⑥增加反应物的浓度
平衡移动的方向:①正反应方向移动 ②逆反应方向移动 ③不移动
| 序号 |
平衡移动的因素(填序号) |
平衡移动的方向(填序号) |
| A |
|
|
| B |
|
|
| C |
|
|
| D |
|
|
T℃时,在容积为2L的3个恒容密闭容器中发生反应:3A(g)+B(g) xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3mol A、2mol B |
6mol A、4mol B |
2mol C |
| 到达平衡的时间(min) |
5 |
|
8 |
| A的浓度(mol/L) |
c1 |
c2 |
|
| C的体积分数 |
w1 |
|
w3 |
| 混合气体密度(g/L) |
ρ1 |
ρ2 |
|
下列说法正确的是
A.若x<4,则2c1>c2
B.若x=4,则w3=w1
C.无论x的值是多少,均有2ρ1=ρ2
D.容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短
试题篮
()