某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)  C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
| t/s |
0 |
5 |
15 |
25 |
35 |
| n(A)/mol |
1.0 |
0.85 |
0.81 |
0.80 |
0.80 |
A.反应在前5 s的平均速率v(A)=0.17 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)
一定条件下存在反应:C(s)+H2O(g)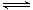 CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
| 容器 |
甲 |
乙 |
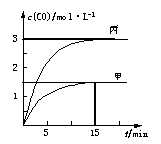 丙 丙 |
| 容积 |
0.5 L |
0.5 L |
V |
| 温度 |
T1 ℃ |
T2 ℃ |
T1 ℃ |
| 起始量 |
2 molC1 molH2O |
1 molCO 1 molH2 |
4 molC 2 molH2O |
下列说法正确的是
A.甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B.丙容器的体积V < 0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)=0.4 mol,则T1 < T2
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol)
2NH3(g)△H=-92.4kJ/mol)
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1mol N2、3mol H2 |
2mol NH3 |
4mol NH3 |
| NH3的浓度(mol·L-1) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
α1 |
α2 |
α3 |
下列说法正确的是
A.2 c1>c3 B.a+b=92.4 C.2 p1<p3 D.α1+α2>1
容积固定的密闭容器中存在如下反应:A(g)+3B(g) 2C(g) △H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g) △H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断一定错误的是
①图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
②图Ⅱ研究的是压强对反应的影响,且甲的压强较高
③图Ⅱ研究的是温度对反应的影响,且甲的温度较高
④图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
| A.①② | B.①③ | C.②④ | D.③④ |
某密闭容器中充入等物质的量的A和B,一定温度下发生反应[A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
| A.30min~40min间该反应使用了催化剂 |
| B.30min时降低温度,40min时升高温度 |
| C.反应方程式中的x=1,正反应为放热反应 |
| D.8min前A的平均反应速率为0.08mol/(L•min) |
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
| A.①是其它条件一定时,反应速率随温度变化的图象,正反应△H<0 |
| B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像 |
| C.③是在有无催化剂存在下建立的平衡过程图象,曲线a是使用催化剂的曲线 |
| D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g) Y(g)+Z(g)△H<0容器内气体总压强p随反应时间t的变化关系如下图所示.以下分析正确的是
Y(g)+Z(g)△H<0容器内气体总压强p随反应时间t的变化关系如下图所示.以下分析正确的是
| A.从反应开始到t1时的平均反应速率v(X)=0.2/t1mol/(L•min) |
| B.该温度下此反应的平衡常数K=0.32mol/L |
| C.欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 |
| D.其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
700℃时,H2(g)+CO2(g) H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示.其中甲经2min达平衡时,v(H2O)为0.025mol/(L•min),下列判断不正确的是
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示.其中甲经2min达平衡时,v(H2O)为0.025mol/(L•min),下列判断不正确的是
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/mlo/L |
0.10 |
0.20 |
0.20 |
| c(CO2)/mlo/L |
0.10 |
0.10 |
0.20 |
A.平衡时,乙中CO2的转化率大于50%
B.当反应平衡时,丙中c(CO2)是甲中的2倍
C.温度升至800℃,上述反应平衡常数为25/16 ,则正反应为吸热反应
D.其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/LCO2,到达平衡时c(CO)与乙不同
某温度下,密闭容器中,发生如下可逆反应:2E(g) F(g)+xG(g);
F(g)+xG(g);
ΔH<0。若起始时E浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5a mol/L;若E的起始浓度改为2a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
| A.若x=l,容器体积保持不变,新平衡下E的体积分数为50% |
| B.升高温度时,正反应速率加快、逆反应速率减慢 |
| C.若x=2,容器体积保持不变,新平衡下F的平衡浓度为0.5a mol·L-1 |
| D.若x=2,容器压强保持不变,新平衡下E的物质的量为a mol |
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
| A.550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动 |
| B.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 |
| C.650℃时,反应达平衡后CO2的转化率为25.0% |
| D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总 |
如右图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2molY, 此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g) 2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是
A.反应速率:v(B)<v(A)
B.平衡时Y的体积分数:A>B
C.打开K后达平衡时A的体积为2.4a L
D.A容器中X的转化率为80%
汽车尾气中,产生NO的反应为:N2(g)+O2(g) 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是:
| A.曲线b对应的条件改变可能是加入了催化剂 |
| B.温度T下,随着反应的进行,混合气体的密度减小 |
C.温度T下,该反应的平衡常数K= |
| D.若曲线b对应的条件改变是温度,可判断该反应的△H<0 |
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是
| A.容器Ⅰ、Ⅱ中正反应速率相同 |
| B.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C.容器Ⅰ中CO的物质的量和容器Ⅱ中的一样多 |
| D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1 |
在盛有足量A的体积可变的密闭容器中,保持压强一定,加入B,发生反应:A(s)+2B(g)⇌4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是
| A.若当温度升高后,则图中θ>45° |
| B.若再加入B,则正、逆反应速率均逐渐增大 |
| C.若再加入B,则再次达到平衡时反应体系气体密度减小 |
| D.平衡时B的转化率为50% |
试题篮
()