恒温恒压下,一个容积可变的密闭容器中发生反应:A(g)+B(g) C(g)。若开始时通入1mol A 和1mol B,则达到平衡时生成a molC.则下列说法错误的是
C(g)。若开始时通入1mol A 和1mol B,则达到平衡时生成a molC.则下列说法错误的是
A.若开始时通入3mol A 和3mol B,则达到平衡时,生成C的物质的量为3a mol
B.若开始时通入4mol A 和4mol B、2molC,则达到平衡时,生成B的物质的量一定大于4 mol
C.若开始时通入2mol A 和2mol B、1mol C,则达到平衡时,在通入3 mol C,则再次达到平衡后,C的体积分数为a /(2-a)
D.若在原平衡体系中,在通入1mol A 和1mol B,则混合气体的平均相对分子质量不变
合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。下列说法正确的是
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。下列说法正确的是

A.由图1可得加入适当的催化剂,E和ΔH都减小
B.图2中0~10 min内该反应的平均速率v(H2)=0.045 mol·L-1·min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d
C.图3中A、B、C三点所处的平衡状态中,反应物N2的转化率最高的是B点
D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2
一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2 CH3OH (g) CH3OCH3(g)+H2O(g),则下列说法正确的是
CH3OCH3(g)+H2O(g),则下列说法正确的是
| 容器 编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH (g) |
CH3OCH3(g) |
H2O (g) |
||
| I |
387 |
0.20 |
0.080 |
0.080 |
| Ⅱ |
387 |
0.40 |
|
|
| Ⅲ |
207 |
0.20 |
0.090 |
0.090 |
A.该反应的正方向应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
某同学在三个容积相同的密闭容器中,分别研究三种不同条件下化学反应2X(g) Y(g)+W(g)的进行情况。其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol·L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是
Y(g)+W(g)的进行情况。其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol·L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是
| A.与实验Ⅰ相比,实验Ⅱ可能使用了催化剂 |
| B.与实验Ⅰ相比,实验Ⅲ若只改变温度,则温度T1<T2,该反应是吸热反应 |
| C.在实验Ⅰ、Ⅱ、Ⅲ中,达到平衡状态时X的体积百分含量相同 |
| D.若起始浓度c(X)=0.8 mol·L-1,c(Y)=c(W)=0,其余条件与实验Ⅰ相同,则平衡浓度c(X)=0.4 mol·L-1 |
用CO合成甲醇(CH3OH)的热化学方程式为CO(g)+2H2(g) CH3OH(g)ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是
CH3OH(g)ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是
| A.温度:T1>T2>T3 |
| B.正反应速率:v(a)>v(c),v(b)>v(d) |
| C.平衡常数:K(a)>K(c),K(b)=K(d) |
| D.平均摩尔质量:M(a)<M(c),M(b)>M(d) |
向密闭容器中充入物质的量浓度均为 0.1 mol/L的CH4 和 CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是

| A.平衡时CO与H2的物质的量比为1:1 |
| B.p1、p2、p3、p4由大到小的顺序为p1<p2<p3<p4 |
| C.1100℃,p4条件下,该反应10 min时达到平衡点X,则ν(CO2) = 0.008 mol•L-1•min-1 |
| D.随着温度升高,该反应的平衡常数减小 |
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) 4NO2(g)+ O2(g) △H >0
4NO2(g)+ O2(g) △H >0
T1温度下的部分实验数据为
| t/s |
0 |
500 |
1000 |
1500 |
| C(N2O5)mol/L |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法不正确的是
A.500s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1000s时转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1 >T2
D.平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时C(N2O5) >5.00mol/L
在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是
CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是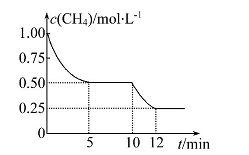
| A.10 min时,改变的外界条件可能是升高温度 |
| B.0~10 min内,v(H2)=0.15 mol·L-1·min-1 |
| C.恒温下,缩小容器体积,一段时间内v(逆)>v(正) |
| D.12 min时,反应达平衡的本质原因是气体总质量不再变化 |
T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
A.在t1min时,3V正(B)=2V逆(C)
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L—1 A、0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
在某一容积为2L的密闭容器内,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);ΔH=a kJ/mol(a>0),反应达到平衡后,测得c(CO):c(CO2)=3:2。下列说法正确的是
CO2(g)+H2(g);ΔH=a kJ/mol(a>0),反应达到平衡后,测得c(CO):c(CO2)=3:2。下列说法正确的是
| A.反应放出的热量为0.2a kJ |
| B.平衡时H2O的转化率为40% |
| C.若升高温度,v(正)加快,v(逆)减慢,平衡正向移动 |
| D.若将容器的体积压缩为1L,有利于该反应平衡正向移动 |
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600(mol/L) -2
2Z,其平衡常数为1600(mol/L) -2
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g) C6H5CH=CH2(g)+H2 (g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),下图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系。下列说法正确的是
C6H5CH=CH2(g)+H2 (g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),下图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系。下列说法正确的是
| A.a、b两点转化率不等,但是化学平衡常数相等 |
| B.b点转化率为50%,则混合气体中苯乙烯的体积分数为1/3 |
| C.恒容时加入稀释剂(水蒸气)能减小C6H5C2H5平衡转化率 |
| D.b点和c点温度和压强相同,故其反应速率也相等 |
700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2)。
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2)。
| 反应时间/min |
n(CO)/mol |
H2O/mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
下列说法正确的是
A.反应在t1 min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升至800℃,上述反应平衡常数为0. 64,则正反应为吸热反应
下列图示与叙述正确的是
| A.图甲表示用0.1000mol/L的NaOH溶液滴定20.00ml,0.1000mol/L的醋酸溶液得到的滴定曲线 |
B.图乙表示压强对可逆反应2A (g)+ B (g) 3C (g)+D (s)的影响且甲的比乙的压强大 3C (g)+D (s)的影响且甲的比乙的压强大 |
C.图丙表示可逆反应Fe3+(aq)+SCN—(aq) Fe(SCN)2+(aq)平衡时,物质的量浓度 [Fe(SCN) 2+]与温度T的关系,反应处于D点时,一定有V(正)>V(逆) Fe(SCN)2+(aq)平衡时,物质的量浓度 [Fe(SCN) 2+]与温度T的关系,反应处于D点时,一定有V(正)>V(逆) |
| D.图丁所示装置可证明溴与苯发生取代反应 |
试题篮
()