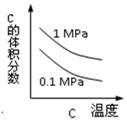
在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g) xC(g);∆H=?符合下图(a)所示的关系w(c)为C的质量分数,由此推断关于图(b)的说法正确的是
xC(g);∆H=?符合下图(a)所示的关系w(c)为C的质量分数,由此推断关于图(b)的说法正确的是
| A.P3>P4,y轴表示A的转化率 |
| B.P3<P4,y轴表示B的体积分数 |
| C.P3<P4,y轴表示混合气体的平均相对分子质量 |
| D.P3>P4,y轴表示混合气体的密度 |
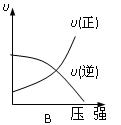
对于可逆反应:2A(g)+B(g)  2C(g) △H<0,下列各图中正确的是
2C(g) △H<0,下列各图中正确的是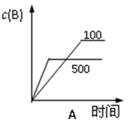
某温度下,密闭容器中发生反应 a X (g) 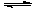 b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
| A.可逆反应的化学计量数:a>b+c | B.压缩容器的容积时,υ正增大,υ逆减小 |
| C.达到新平衡时,物质X的转化率减小 | D.达到新平衡时,混合物中Z的质量分数增大 |
已知,H2(g) +I2(g)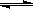 2 HI(g)DH <0有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2 HI(g)DH <0有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
| A.甲降低温度,乙不变 | B.甲中加入0.1molHe,乙不改变 |
| C.甲、乙提高相同温度 | D.甲增加0.1mol H2,乙增加0.1mol I2 |
一定温度下,将1molA和1molB气体充入2L恒容密闭容器,发生A(g)+ B(g) xC(g)+D(s),t1时达到平衡,在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示,正确的是
xC(g)+D(s),t1时达到平衡,在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示,正确的是
| A.方程式中x=1 | B.t2时刻改变是使用催化剂 |
| C.t3时刻改变是移去少量物质D | D.t1~t3间该反应的平衡常数均为4 |
在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g) 2c(g);△H<0 x(g)+3y(g)
2c(g);△H<0 x(g)+3y(g) 2z(g);△H>0
2z(g);△H>0
进行相关操作且达到平衡后(忽略体积改变所做的功),叙述错误的是
| A.等压时,通入惰性气体,c的物质的量不变 |
| B.等压时,通入z 气体,反应器中温度升高,c的物质的量改变 |
| C.等容时,通入惰性气体,各反应速率不变,混合气体平均摩尔质量不一定增大 |
| D.等容时,通入z气体,y的物质的量浓度增大,z的质量分数增加 |
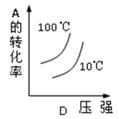
在某容积一定的密闭容器中,可逆反应:A(g)+B(g) xC(g),符合下列图象(Ⅰ)所示关系.由此推断对图(Ⅱ)的正确说法是 ( ).
xC(g),符合下列图象(Ⅰ)所示关系.由此推断对图(Ⅱ)的正确说法是 ( ).
| A.p3>p4,Y轴表示A的质量 |
| B.p3<p4,Y轴表示B的百分含量 |
| C.p3>p4,Y轴表示混合气体密度 |
| D.p3>p4,Y轴表示混合气体平均摩尔质量 |
在一恒温恒容密闭容器中,A、B气体可建立如下平衡:2A(g)+2B(g) C(g)+3D(g)现分别从两条途径建立平衡:I.A、B的起始量均为2mol;Ⅱ.C、D的起始量分别为2mol和6mol。下列叙述不正确的是: ( )
C(g)+3D(g)现分别从两条途径建立平衡:I.A、B的起始量均为2mol;Ⅱ.C、D的起始量分别为2mol和6mol。下列叙述不正确的是: ( )
A.I、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同
B.I、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成不同
C.达到平衡时,途径I的和途径Ⅱ体系内混合气体平均相对分子质量相同
D.达到平衡时,途径I的气体密度为途径Ⅱ密度的1/2
已知:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH =-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )
CH3OH(g) + H2O(g) ΔH =-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )
A.升高温度能使 增大 增大 |
| B.反应达到平衡状态时,CO2的平衡转化率为75% |
| C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1 |
一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的容器中,发生反应:2SO2+O2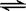 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是
| A.2 mol SO2+ 1 mol O2 | B.1mol SO2+ 1 mol O2 |
| C.2 mol SO2+ 1 mol O2+ 2 mol SO3 | D.1 mol SO2+ 1 mol SO3 |
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二。
下列分析不正确的是:( )
A.0~4分钟时,A的速率为0.01mol/(L•min) B.由T1向T2变化时,V正> V逆
C.该反应的平衡常数表达式K= D.此反应的正反应为吸热反应.
D.此反应的正反应为吸热反应.
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,并于10 min时达到平衡:PCl3(g)+Cl2(g)  PCl5(g) △H<0。有关数据如下:
PCl5(g) △H<0。有关数据如下:
| |
PCl3(g) |
Cl2(g) |
PCl5(g) |
| 初始浓度/(mol/L) |
2.0 |
1.0 |
0 |
| 平衡浓度/(mol/L) |
(1.6)c1 |
(0.6)c2 |
0.4 |
下列判断不正确的是( )
A.10 min内,v(Cl2)=0.04 mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,
c(PCl5)<0.2 mol/L
试题篮
()