碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g) 2CH3OCOOC2H5(g).其他条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比( R=n(C2H5OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法正确的是
2CH3OCOOC2H5(g).其他条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比( R=n(C2H5OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法正确的是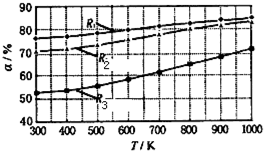
| A.该反应的逆反应△H>0 |
| B.增大反应物中CH3OCOOCH3的浓度能提高碳酸甲乙酯的平衡转化率 |
| C.650℃,反应物配比为1:1时,平衡常数K=6 |
| D.当C2H5OCOOC2H5与CH3OCOOC2H5生成速率比为1:2时,反应达到平衡状态 |
在不同温度下,向VL密闭容器中加入0.5 mol NO和0.5 mol活性炭,发生反应:
2NO(g)+C(s) N2 (g)+CO2 (g) △H= —QkJ·mol-1 (Q>0),达到平衡时的数据如下:
N2 (g)+CO2 (g) △H= —QkJ·mol-1 (Q>0),达到平衡时的数据如下:
| 温度/℃ |
n (C)/mol |
n(CO2)/mol |
| T1 |
|
0. 15 |
| T2 |
0. 375 |
|
下列有关说法正确的是
A.由上述信息可推知:T1>T2
B.T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)增大
C.T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大
D.T1℃时,该反应的平衡常数
某密闭容器中充入等物质的量的气体A和B,一定温度下发生如下反应:A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化关系如图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化关系如图所示。下列说法中正确的是
| A.反应方程式中的x=1, 30min时改变条件后,A的转化率将变减小 |
| B.前30 min内 A的反应速率为0.05 mol/(L·min) |
| C.20至40 min内表示处于平衡状态,该反应为放热反应 |
| D.30 min时改变的条件是加入负催化剂,40 min时改变的条件是升高温度 |
已知2SO2(g)+ O2(g) 2SO3(g) △H=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3;恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3(g) △H=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3;恒温、恒容下反应达平衡时,下列关系一定正确的是
| A.容器内压强p:p甲=p丙<2p乙 |
| B.SO3的质量m:m甲=m丙<2m乙 |
| C.c(SO2)与c(O2)之比k:k甲=k丙>k乙 |
| D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙 |
下列图示与对应的叙述相符的是
| A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图Ⅱ表示常温下,0. 100 mol/L NaOH溶液滴定20. 00 mL、0.100 mol/L HC1溶液所得到的滴定曲线。 |
| C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c<a<b |
D.图Ⅳ表示反应 ,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a ,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a |
在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应: 。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物的投入量 |
3 molH2、2 molN2 |
6 molH2、4 molN2 |
2 molNH3 |
| 达到平衡的时间/min |
|
5 |
8 |
| 平衡时N2的浓度/ mol·L-1 |
c1 |
1.5 |
|
| NH3的体积分数 |
φ1 |
|
φ2 |
| 混合气体的密度/g·L-1 |
ρ1 |
ρ2 |
|
下列说法不正确的是
A.容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol·L-1·min-1
B.在该温度下甲容器中反应的平衡常数
C.2c1<1.5
D.2ρ1=ρ2
已知反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0.某温度下,将2 mol SO2和1 mol O2置于 10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g) ΔH<0.某温度下,将2 mol SO2和1 mol O2置于 10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
| A.由图甲知,B点SO2的平衡浓度为0.3mol·L-1 |
| B.由图甲知,A点对应温度下的平衡常数为80 |
| C.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
| D.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示 |
下列图示与对应的叙述相符的是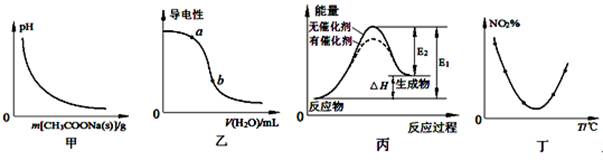
| A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 |
| B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
| C.图丙表示催化剂能改变化学反应的焓变 |
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g) N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |
【改编】某温度下,恒容密闭容器中,发生如下可逆反应:2 E(g)  F(g) + x G(g)(正反应放热);若起始时E浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5amol/L,若E的起始浓度改为2amol/L,F、G 浓度仍为0,当达到新的平衡时,下列说法正确的是
F(g) + x G(g)(正反应放热);若起始时E浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5amol/L,若E的起始浓度改为2amol/L,F、G 浓度仍为0,当达到新的平衡时,下列说法正确的是
| A.升高温度时,正反应速率加快,逆反应速率减慢,平衡逆向移动 |
| B.若x=1,新平衡下E转化率为50% |
| C.若x=2,新平衡下F的平衡浓度为0.5a mol/L |
| D.若x=2,换成恒压容器,则达到平衡所需时间比恒容容器所需时间短 |
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:
A(g)+xB(g) 2C(g) ΔH=a kJ·mol-1
2C(g) ΔH=a kJ·mol-1
各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如下表和下图:
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
0.5 L |
0.5 L |
1.0 L |
| 温度/℃ |
T1 |
T2 |
T2 |
| 反应物 起始量 |
1.5 mol A 0.5 mol B |
1.5 mol A 0.5 mol B |
6.0 mol A 2.0 mol B |

下列说法不正确的是
A.10 min内甲容器中反应的平均速率v(A)=0.10 mol·L-1·min-1
B.其他条件不变,甲容器中在20 min后,降低温度,平衡向正反应方向移动
C.保持其他条件不变,若起始时向乙容器中充入3.0 mol A、1.0 mol B和2.0 mol C,则反应达到新平衡前v(逆)>v(正)
D.T2℃,向丙容器的平衡体系中再充入1.5 mol A、0.5 mol B,平衡时C的体积分数大于25%
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g) + 3Y2(g) 2XY3(g) △H=-92.6 kJ.mol-1
2XY3(g) △H=-92.6 kJ.mol-1
| 容器 编号 |
起始时各物质物质的量/mol |
达到平衡的时间 |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
|||
| ① |
1 |
3 |
0 |
2分钟 |
放热46.3kJ |
| ② |
0.4 |
1.2 |
1.2 |
/ |
Q(Q>0) |
实验测得反应在起始、达到平衡时的有关数据如下表所示,下列叙述不正确的是
A.容器①中反应达平衡时用XY3表示的反应速率为v(XY3)=1/30moI.L-l·s-1
B.平衡时,两个容器中XY3的物质的量浓度相等
C.容器②中反应达到平衡时吸收的热量为Q
D.若容器①体积为0.3L,则达平衡时放出的热量大于46.3kJ
【改编】向甲、乙、丙三个恒温恒容的密闭容器中,发生反应:A(g)+B(g)  xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示:
| 容器 |
甲 |
乙 |
丙 |
| 容积(L) |
0.5 |
0.5 |
0.5 |
| 能量变化(kJ) |
Q1 |
Q2 |
Q3 |
| 反应物起始量 |
A、B各1 mol |
A、B各0.5 mol |
C 0.5 mol |

下列说法正确的是
A.x=1
B.Q1=2Q3
C.根据题中信息无法计算a值
D.保持其他条件不变,起始时充入A、B、C各2mol,则此时向逆反应方向移动
根据下列有关图象,说法正确的是
| A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 |
| B.由图Ⅱ知,反应在t6时,NH3体积分数最大 |
| C.由图Ⅱ知,t3时采取降低反应温度的措施 |
| D.图Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量 |
液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s)  NH3(g) + HI(g)
NH3(g) + HI(g)
b.2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
①写出反应a的平衡常数表达式
②达到平衡后,扩大容器体积,反应b的移动方向 (填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化 (填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g)  2NH3(g) ΔH=-92.60 kJ·mol-1
2NH3(g) ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
(4)肼(N2H4)的性质类似于NH3,极易溶于水,与水反应生成一种二元弱碱在溶液中分步电离,请用离子反应方程式表示其水溶液显碱性的原因 。
一定温度下,有可逆反应:2A(g)+2B(g) C(g)+3D(g) ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
C(g)+3D(g) ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
关于两容器中反应的说法正确的是
| A.甲容器中的反应先达到化学平衡状态 |
| B.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示 |
| C.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同 |
| D.在甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度与乙中物质C的浓度相等 |
试题篮
()