某化学反应:A(g)  B(g)+C(g),在温度为3 00K时,向2.0L恒容密闭容器中充入1.0mol A,反应过程中测得的B物质的物质的量随时间的变化关系如图,下列说法不正确的是
B(g)+C(g),在温度为3 00K时,向2.0L恒容密闭容器中充入1.0mol A,反应过程中测得的B物质的物质的量随时间的变化关系如图,下列说法不正确的是
A.0~50秒,A物质化学反应速率v(A)=0.0016mo1·L-1·S-1
B.250s时该反应达到化学平衡状态
C.若改加入2.0mol A,A的平衡转化率大于20%
D.300K时,该反应的平衡常数为0.025 mol·L-1
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:
CH4(g)+ H2O(g)  CO(g) + 3H2(g)
CO(g) + 3H2(g)
其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示。下列说法正确的是
| A.相同条件下,催化剂Ⅱ催化效率更高 |
| B.b点表示上述反应在对应条件下的平衡状态 |
| C.根据图象,无法判断该反应是否为吸热反应 |
| D.该反应平衡常数表达式为K=c(CO)·c3(H2) /c(CH4) |
在可逆反应2A(g)+3B(g) xC(g)+D(g)中,起始浓度:A为5 mol·L-1,B为3 mol·L-1。若v(C)="0.5" mol·(L·min)-1,2 min末,测得D的浓度为0.5 mol·L-1。则下列说法中正确的是
xC(g)+D(g)中,起始浓度:A为5 mol·L-1,B为3 mol·L-1。若v(C)="0.5" mol·(L·min)-1,2 min末,测得D的浓度为0.5 mol·L-1。则下列说法中正确的是
A.2 min末,A和B的浓度之比为5∶3
B.x=1
C.2 min末,B的浓度为1.5 mol·L-1
D.2 min末,A消耗的浓度为0.5 mol·L-1
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni (s)+4CO (g)  Ni(CO)4 (g),已知该反应平衡常数与温度的关系如表:
Ni(CO)4 (g),已知该反应平衡常数与温度的关系如表:
| 温度/℃ |
25 |
80 |
230 |
| 平衡常数 |
5×104 |
2 |
1.9×10﹣5 |
下列说法不正确的是
A. 上述生成Ni(CO)4 (g)的反应为放热反应
B. 25℃时反应Ni(CO)4 (g)  Ni (s)+4CO (g)的平衡常数为2×10﹣5
Ni (s)+4CO (g)的平衡常数为2×10﹣5
C. 80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L
D. 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)
利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g) CH3OH(g)。在体积一定的密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g)。在体积一定的密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
A.该反应的△H<0,且p1<p2
B.反应速率:ν逆(状态A)>ν逆(状态B)
C.在C点时,CO转化率为75%
D.在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
下列各表述与示意图一致的是( )

A.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| B.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| C.图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 |
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 |
在体积恒定的密闭容器中,一定量的SO2与1.00mol O2在催化剂作用下加热到600℃发生反应:2SO2+O2 2SO3ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气体压强为反应前的92.125%。下列有关叙述正确的是
2SO3ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气体压强为反应前的92.125%。下列有关叙述正确的是
| A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 |
| B.达到平衡时,O2的转化率是31.5% |
| C.达到平衡时,SO2的转化率是31.5% |
| D.降低温度,正反应速率减小程度比逆反应速率减小程度大 |
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)  2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
0.5 L |
0.5 L |
1.0 L |
| 温度/℃ |
T1 |
T2 |
T2 |
| 反应物起始量 |
1.5 mol A 0.5 mol B |
1.5 mol A 0.5 mol B |
6.0 mol A 2.0 mol B |
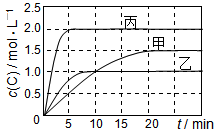
下列说法正确的是
A.10min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B.由图可知:T1<T2,且该反应为吸热反应
C.若平衡时保持温度不变,改变容器体积平衡不移动
D.T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25%
在容积一定的密闭容器中,发生可逆反应:A(g)+B(g) xC(g),有如图(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,则下列说法中正确的是
xC(g),有如图(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,则下列说法中正确的是
| A.x=2,T1>T2,P2>P1 |
| B.P3>P4,y轴表示B的质量分数 |
| C.P3<P4,y轴表示混合气体的密度 |
| D.P3>P4,y轴表示混合气体的平均摩尔质量 |
在不同温度下,向V L密闭容器中加入0.5 mol NO和0.5 mol活性炭,发生反应:
2NO(g)+C(s)  N2 (g)+CO2 (g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
N2 (g)+CO2 (g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
| 温度/℃ |
n (C)/mol |
n(CO2)/mol |
| T1 |
|
0.15 |
| T2 |
0.375 |
|
下列有关说法正确的是
A.由上述信息可推知:T1 > T2
B.T2℃时,若反应达平衡后再缩小容器的体积,c (N2):c (NO)增大
C.T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大
D.T1℃时,该反应的平衡常数
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图所示,下列条件错误的是
| A.从反应开始到第一次达到平衡时,A物质的平均反应速率为0.067mol/(L·min) |
B.根据图该反应的平衡常数表达式为k=  |
| C.若在第5分钟时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大 |
| D.若在第7分钟时增加D的物质的量,A的物质的量变化情况符合b曲线 |
汽车尾气中,产生NO的反应为:N2(g)+O2(g) 2NO(g),一定条件下,等物质的量的N2(g)和O2(g).在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是
2NO(g),一定条件下,等物质的量的N2(g)和O2(g).在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是
A.温度T下,该反应的平衡常数K= |
| B.温度T下,随着反应的进行,混合气体的密度减小 |
| C.曲线b对应的条件改变可能是加入了催化剂 |
| D.若曲线b对应的条件改变是温度,可判断该反应的△H<0 |
羰基硫(COS)可用作粮食熏蒸剂,可由CO 与H2S 在一定条件下反应制得。在恒容的密
闭容器中发生反应并达到平衡: ,数据如下表
,数据如下表
所示:
下列说法正确的是
| A.上述反应是吸热反应 |
| B.实验1 达平衡时,CO 的转化率为70% |
| C.实验2 达平衡时,a<7.0 |
| D.实验3 达平衡后,再充入1.0molH2,K 值增大,平衡逆向移动 |
试题篮
()