(I)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg HgBr2+H2
HgBr2+H2
③HgBr2+_____ _____ + ④2HgO
_____ + ④2HgO 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________ _。
根据“绿色化学”的思想评估该方法制H2的主要缺点:________ __。
(II)氢气常用生产水煤气的方法制得。CO(g)+H2O(g) CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2和x mol H2,则:
①当x = 5.0时,上述平衡向___________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
(3)在850℃时,若x="5.0" mol,其它物质的投料不变,当上述反应达到平衡后,求H2的体积分数(计算结果保留两位有效数字)。
I.工业上可用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)“图1”表示反应中能量的变化,曲线 (填“a或b”)表示使用了催化剂;该反应的热化学方程式为 。
(2)若容器容积不变,下列措施可增大CO平衡转化率的是_____。
| A.升高温度 |
| B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 |
| D.再充入1 mol CO和2 mol H2 |
(3)其他条件不变,请在“图2”中画出温度为T2(且T2<T1)时,CO的平衡转化率与H2和CO的起始组成比[n(H2)/n(CO)]的关系曲线。
II.向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生的反应可表示为:BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)。
BaCO3(s)+SO42-(aq)。
(4)现有0.20 mol BaSO4,加入1.0L 2.0mol/L的饱和Na2CO3溶液处理,假设起始的c(SO42-)≈0,平衡时,K=4.0×10-2,求达到平衡时发生转化的BaSO4的物质的量。(写出计算过程,计算结果保留2位有效数字)
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
2CO(g)+SO2(g)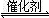 2CO2(g)+S(l) △H
2CO2(g)+S(l) △H
(1)已知2CO(g)+O2(g)= 2CO2(g) △H1=—566kJ•mol—1
S(l) +O2(g)= SO2(g) △H2=—296kJ•mol—1
则反应热ΔH= kJ•mol-1。
(2)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图a。260℃时 (填Fe2O3、NiO或Cr2O3)作催化剂反应速率最快。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑价格因素,选择Fe2O3的主要优点是 。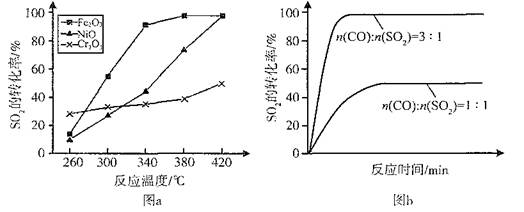
(3)科研小组在380℃、Fe2O3作催化剂时,研究了不同投料比[n(CO)∶n(SO2)]对SO2转化率的影响,结果如图b。请在答题卡坐标图中画出n(CO)∶n(SO2)="2∶1" 时,SO2转化率的预期变化曲线。
(4)工业上还可用Na2SO3溶液吸收烟气中的SO2:Na2SO3+SO2+H2O=2NaHSO3。某温度下用1.0mol•L-1 Na2SO3溶液吸收纯净的SO2,当溶液中c(SO32-)降至0.2mol•L-1时,吸收能力显著下降,应更换吸收剂。
①此时溶液中c(HSO3-)约为______mol•L-1;
②此时溶液pH=______。(已知该温度下SO32—+H+ HSO3—的平衡常数K="8.0" × 106 L•mol-1,计算时SO2、H2SO3的浓度忽略不计)
HSO3—的平衡常数K="8.0" × 106 L•mol-1,计算时SO2、H2SO3的浓度忽略不计)
工业合成氨的反应为:N2(g)+3H2(g)  2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
(1)反应开始3min内,H2的平均反应速率为 。
(2)计算该条件下合成氨反应的化学平衡常数(写出计算过程,结果保留2位有效数字)。
(3)仅改变温度为T2 ( T2小于TI)再进行实验,请在答题卡框图中画出H2的物质的量随
反应时间变化的预期结果示意图。
(4)在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
写出上述CO与H2O(g)反应的热化学方程式: 。
(5)合成氨工业中,原料气(N2、H2混有少量CO、NH3)在进入合成塔之前,用醋酸二氨合铜(I)溶液来吸收CO其反应为:CH3COO[Cu(NH3)2]+CO+NH3 CH3COO[Cu(NH3)3]•CO △H<0。写出提高CO吸收率的其中一项措施: 。
CH3COO[Cu(NH3)3]•CO △H<0。写出提高CO吸收率的其中一项措施: 。
金属铁用途广泛,高炉炼铁的总反应为:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g),请回答下列问题:
2Fe(s)+3CO2(g),请回答下列问题:
(1)一定温度下,在体积固定的密闭容器中发生上述反应,可以判断该反应已经达到平衡的是 。
| A.密闭容器中总压强不变 |
| B.密闭容器中混合气体的平均摩尔质量不变 |
| C.密闭容器中混合气体的密度不变 |
| D.c(CO)= c(CO2) |
E.Fe2O3的质量不再变化
(2)一定温度下,上述反应的化学平衡常数为3.0,该温度下将4molCO、2molFe2O3、6molCO2、5molFe加入容积为2L的密闭容器中,此时反应将向 反应方向进行(填“正”或“逆”或“处于平衡状态”);反应达平衡后,若升高温度,CO与CO2的体积比增大,则正反应为 反应(填“吸热”或“放热”) 。
(3)已知:3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) △H="–47" kJ/mol
2Fe3O4(s)+CO2(g) △H="–47" kJ/mol
Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) △H=" +19" kJ/mol
3FeO(s)+CO2(g) △H=" +19" kJ/mol
FeO(s)+CO(g) Fe(s)+CO2(g) △H="–11" kJ/mol
Fe(s)+CO2(g) △H="–11" kJ/mol
则Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)的△H= 。
2Fe(s)+3CO2(g)的△H= 。
(4)上述总反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
| 温度 |
250℃ ~ 600℃ ~ 1000℃ ~ 2000℃ |
| 主要成分 |
Fe2O3 Fe3O4 FeO Fe |
800℃时固体物质的主要成分为 ,该温度下若测得固体混合物中m(Fe)︰m(O)=105︰32,则Fe3O4被CO还原为FeO的百分率为 (设其它固体杂质中不含Fe、O元素)。
I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s) + 3CO(g) 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)已知:①Fe2O3(s) + 3C(石墨)="2Fe(s)" + 3CO(g) △H1
②C(石墨)+ CO2(g) = 2CO(g) △H2
则△H___________________(用含△H1 、△H2的代数式表示)。
(2)高炉炼铁反应的平衡常数表达式K=____________________________。
(3)在某温度时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| |
Fe2O3 |
CO |
Fe |
CO2 |
| 甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
| 乙/mol |
1.0 |
1.5 |
1.0 |
1.0 |
①甲容器中CO的平衡转化率为_______________________。
②下列说法正确的是____________________(填编号)。
A.若容器压强恒定,反应达到平衡状态
B.若容器内气体密度恒定,反应达到平衡状态
C.甲容器中CO的平衡转化率大于乙的
D.增加Fe2O3就能提高CO的转化率
II.纳米MgO可用尿素与氯化镁合成。某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响。请完成以下实验设计表:
| 编号 |
温度/K |
反应时间/h |
反应物物质的量配比 |
实验目的 |
| ① |
378 |
4 |
3∶1 |
实验②和④探究________ ______________________ 实验②和__________探究 反应时间对产率的影响。 |
| ② |
378 |
4 |
4∶1 |
|
| ③ |
378 |
3 |
_______ |
|
| ④ |
398 |
4 |
4∶1 |
下图为温度对纳米MgO产率(曲线a)和粒径(曲线b)的影响,请归纳出温度对纳米MgO制备的影响规律(写出一条):
___________________________________________。
I.甲醇是一种优质燃料,可制作燃料电池。工业上可用下列两种反应制备甲醇:
已知:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
2H2(g)+ O2(g)=2H2O(g) ΔH3
则2CO(g)+O2(g)=2CO2(g) 的反应热ΔH=____ ___(用ΔH1、ΔH2、ΔH3表示)。
II.工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量的影响如下图: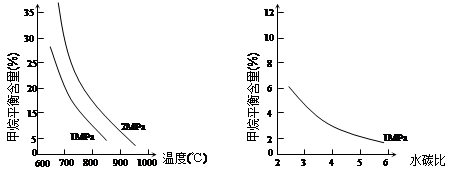
图1(水碳比为3) 图2(800℃)
(1)温度对该反应的反应速率和平衡移动的影响是 。
(2)其他条件不变,请在图2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(3)已知:在700℃,1MPa时,1mol CH4与1mol H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
III.某实验小组设计如图a所示的电池装置,正极的电极反应式为____ ____。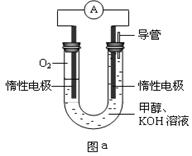
目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l)
2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) △H=" +1530.0kJ" /mol。
4NH3(g)+3O2(g) △H=" +1530.0kJ" /mol。
(1)氢气的燃烧热△H=_______________kJ/mol。
(2)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是 。
| A.气体体积不再变化,则已平衡 |
| B.气体密度不再变化,尚未平衡 |
| C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动 |
| D.平衡后,压缩装置,生成更多NH3 |
(3)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如下。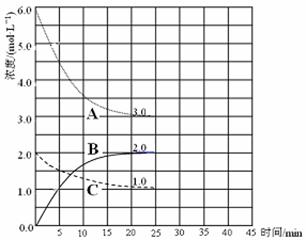
① 表示N2浓度变化的曲线是 。
② 前25 min 内,用H2浓度变化表示的化学反应速率是 。
③ 在25 min末刚好平衡,则平衡常数K = 。
(4)在第25 min 末,保持其它条件不变,升高温度,在第35 min末再次平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(5)已知常温下,NH4+ 的水解常数为1.0×10-9,则0.1mol/L NH4Cl溶液pH= 。(忽略NH4+水解对NH4+浓度的影响)
(1)N2(g)+3H2(g) 2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。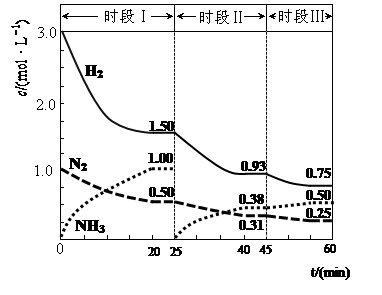
①在1L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 ;
②25min时采取的措施是 ;
③时段III条件下,反应的平衡常数表达式为 (用具体数据表示)。
(2)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。
5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。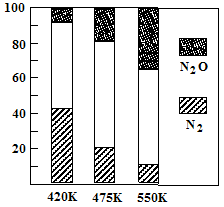
(3)直接供氨式燃料电池是以NaOH溶液为电解质的。电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为 。
甲醇是一种可再生能源,具有开发和应用的广阔前景。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)下列有关上述反应的说法正确的是________。
a.恒温、恒容条件下,容器内的压强不发生变化则可逆反应达到平衡
b.一定条件下,H2的消耗速率是CO的消耗速率的2倍时可逆反应达到平衡
c.保持容器体积不变,升高温度可提高CO的转化率
d.使用合适的催化剂能缩短达到平衡的时间并提高CH3OH的产量
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。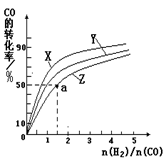
①在上述三种温度中,曲线Z对应的温度是 。
②利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K (写出计算过程)。
③在答题卡相应位置上画出:上述反应达到平衡后,减小体系压强至达到新的平衡过程中,正逆反应速率与时间的变化关系图并标注。
(3)已知:CO(g)+ O2(g)=CO2(g) △H2=-283 kJ·mol-1
O2(g)=CO2(g) △H2=-283 kJ·mol-1
H2(g)+ O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为 。
甲烷和氨在国民经济中占有重要地位。
(1)制备合成氨原料气H2,可用甲烷蒸汽转化法,主要转化反应如下:
CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CH4(g) + 2H2O(g)  CO2(g) +4H2(g) ΔH = +165.0kJ/mol
CO2(g) +4H2(g) ΔH = +165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ |
165 |
175 |
185 |
195 |
| K |
111.9 |
74.1 |
50.6 |
34.8 |
① 反应热ΔH(填“>”、“<”或“=”)_______0。
② 在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)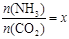 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。求图中的B点处,NH3的平衡转化率。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。求图中的B点处,NH3的平衡转化率。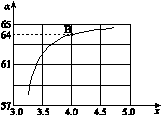
(3)已知甲烷燃料电池的工作原理如下图所示。该电池工作时,a口放出的物质为_________,该电池正极的电极反应式为:____ ,工作一段时间后,当3.2g甲烷完全反应生成CO2时,有 mol 电子发生转移。
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生的反应:
C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ/mol ①
C(s)+ CO2(g)  2CO(g) ΔH2="+172.5" kJ/mol ②
2CO(g) ΔH2="+172.5" kJ/mol ②
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) ΔH3="-13.7" kJ/mol ③
请回答下列问题:
(1) 计算3 Fe(s)+2 O2(g)= Fe3O4(s)的ΔH=__________________________。
(2) 800℃时,C(s)+ CO2(g)  2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.2mol/L、c(CO2)=0.05mol/L,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.2mol/L、c(CO2)=0.05mol/L,此时反应向_______(填“正”或“逆”)方向进行。
(3) 某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol/L的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
计算:①该铁矿石中铁元素的质量分数。
②计算氧化物FemOn的化学式( m、n为正整数)。
试题篮
()