830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g)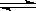 CO2(g)+H2(g)△H<0 试回答下列问题
CO2(g)+H2(g)△H<0 试回答下列问题 :
:
(1) 若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在此温度下,该反应的平衡常数K=
若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在此温度下,该反应的平衡常数K=
(2)在相同温度下,起始物质按下列四种配比充入该容器中,c(H2O)=2mol·L-1,c(CO)=c(CO2)="1" mol·L-1,c(H2)="1.5" mol·L-1,则此时该反应是否达到平衡状态 (选填“是”与“否”),此时v正 v逆(选填“大于”、“小于”或“等于”)。
(3)平衡时若降低温度,该反应的K值将 (选填“增大”、“减小”或“不变”),平衡 移动(选填“正向”、“逆向”或“不”)。
向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应: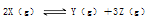
(1)经5min后达平衡,此时容器内压强为起始时的1.2倍,则用Y表示的速率为____________mol(L·min)。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一时间内测得的反应速率分别为:甲:ν(X)=3.5mol(L·min);乙:ν(Y)=2mol(L·min);丙:ν(Z)=4.5mol(L·min);丁:ν(X)=0.075mol(L·s)。若其他条件相同,温度不同,温度由高到低的顺序是(填序号)________________。
(3)若向达到(1)的平衡体系中充入氮气,则平衡 向___(填“左”“右”或“不”,下同)移动;若将达到(1)的平衡体系中移走部分混合气体,则平衡向___移动。
向___(填“左”“右”或“不”,下同)移动;若将达到(1)的平衡体系中移走部分混合气体,则平衡向___移动。
(4)若在相同条件下向达到(1)所述平衡体系中再充入0.5molX气体,则平衡后X的转化率与(1)的平衡中X的转化率相比___
| A.无法确定 | B.前者一定大于后者 |
| C.前者一定等于后者 | D.前者一定小于后者 |
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达平衡时仍与(1)的平衡等效,则a、b、c应满足的关系为____________。
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为amol、bmol、cmol,达平衡时仍与(1)的平衡等效,则起始时维持化学反应向逆反应方向进行,则c的取值范围应为______________。
将1mol CO和1mol H2O充入某固定容积的反应器中,在某条件下达到平衡:CO+H2O(g)?CO2+H2,此时有2/3的CO转化为CO2。
(1)该平衡混合物中CO2的体积分数为__________。
(2)若在相同条件下,向容器中充入1mol CO2、1mol H2和1mol H2O,则达到平衡时与(1)中平衡相比较,平衡应向__________(填“正反应方向”、“逆反应方向”或“不”)移动,此时平衡混合物中CO2的体积分数可能是下列各值中的__________
| A.22.2% | B.27.55% | C.33.3% | D.36.8% |
(3)结合(2)中计算结果分析若平衡向正反应方向移动时,则下列说法中正确的是__________。
①生成物的产量一定增加;②生成物的体积分数一定增加;③反应物的转化率一定增大;④反应物的浓度一定降低;⑤正反应速率一定大于逆反应速率;⑥一定使用了催化剂
t ℃将3molA和2molB气体通入固定体积为2L的密闭容器中,发生如下反应:
3A(g)+ B(g) XC(g),2min时反应达平衡。(温度不变)剩余1.8molB,
XC(g),2min时反应达平衡。(温度不变)剩余1.8molB,
并测得C的物质的量为0.8mol,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 ,X= 。
(2)比较达到平衡时,A.B两反应物的转化率:α(A) α(B)(填> = 或 < )
(3)若继续向原平衡混合物的容器中通入少量氩气(氩气和A.B.C均不反应)后,则平衡
(填“向左移动” “ 向右移动” “不移动”)
(4)在t ℃时,若向原平衡混合物的容器中再充入amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入 mol(填A或B物质并用含a的式子表示量的多少)
Ⅰ.在一定条件下,xA+yB zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
(1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向 方向移动。
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为 。
Ⅱ.已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图。
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图。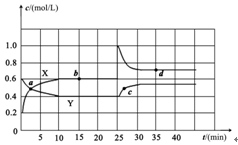
(1)图中共有两条曲线X和Y,其中曲线 表示NO2浓度随时间的变化;
a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
下列不能说明该反应已达到平衡状态的是 。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均分子量不随时间变化而改变
(2)前10min内用NO2表示的化学反应速率v(NO2)= 。
(3)反应25min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是 (用文字表达);
(4)若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25min时还可以采取的措施是 。
A.加入催化剂 B.缩小容器体积 C.升高温度 D.加入一定量的N2O4
高炉炼铁中发生的基本反应之一如下:
FeO(s)+ CO (g)  Fe(s)+ CO2(g) △H>0
Fe(s)+ CO2(g) △H>0
(1)此反应的平衡常数表达式为:K=
(2)温度升高,达到新的平衡后,高炉内CO2与CO的体积比 (填“增大”、 “减小”或“不变”)。
(3)已知1100℃时,K= 0.263。某时刻测得高炉中c(CO2)=" 0.025" mol·L-1,c(CO)=" 0.1" mol·L-1,在这种情况下,该反应 (填“是”或“不是”)处于化学平衡状态。
如果“不是”,此时化学反应向 方向进行(填“正反应”或“逆反应”)。如果“是”,此空不填
高炉炼铁中发生的基本反应如下:FeO(s)+CO(g)s Fe(s)+CO2(g) △H>0。
Fe(s)+CO2(g) △H>0。
(1)下列可以作为判断该反应已经达到化学平衡状态依据的是 。
a.高炉内压强不变
b.CO2的生成速率和CO的生成速率相等
c.混合气体中CO2的浓度不变
d.c(CO2)=c(CO)
(2)此反应的平衡常数表达式为K= 。
(3)温度升高平衡常数K值 (填“增大”“减小”、或“不变”)。
(4)已知1100℃时,K=0.263,此时测得高炉中c(CO2)="0.025mol/L" ·c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态 (填“是”或“否”),此时化学反应速率是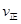
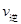 (填“<”、“>”或“=”),其原因是 。
(填“<”、“>”或“=”),其原因是 。
(15分)甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下,发生如下反应制得: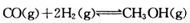 。请根据图示回答下列问题:
。请根据图示回答下列问题: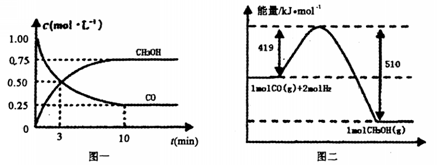
(1) 从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=________。
(2) 写出该反应的热化学方程式________________
(3) 恒容条件下,下列措施中能使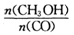 增大的有________________
增大的有________________
A升高温度 B充人He气
C再充入1molCO和2mol H 2 D使用催化剂
(4) 若在温度和容器相同的三个密闭容器中,按不同方式投人反应物.,测得反应达到平衡吋的有关数据如下表: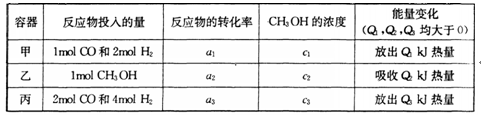
则下列关系正确的是________
A c1=c2 B. 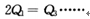
C. 2a1=a3 D. a1 +a2 =1
E该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(5) 若在一体积可变的密闭容器中充入l mol CO 2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动,理由是________________
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为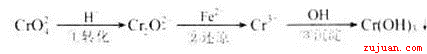
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) ="v" (CrO42—) c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
( 4 ) 第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+ (aq)+3OH—(aq)
Cr3+ (aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为 。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
已知:化合物B、C、E中含有两种相同的元素,A可用于玻璃、洗涤剂等的生产,B可用于制作光纤,G的组成元素与D相同。这些化合物之间存在下图所示的转化关系。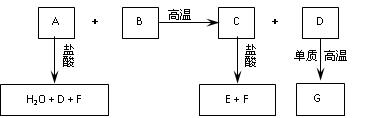
请回答:
(1)在化合物A、C、F中含有的 相同元素 。
相同元素 。
(2)化合物C的化学式为 ,其水溶液的pH 7(填“>”或“<”) 。
。
(3) 700 ℃时,向容积为 2 L的密闭容器中充入一定量的G(g)和H2O(g),发生反应:
2 L的密闭容器中充入一定量的G(g)和H2O(g),发生反应:
G(g)+H2O(g)  D(g)+H2(g)。反应过程中测定的部分数据见下表(表中t1>t2):
D(g)+H2(g)。反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min |
n(G)/mol |
n(H2O)/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
① 反应在t1min内的平均速率为v(H2)= mol/(L·min)
② 保持其他条件不变,起始时向容器中充入0.60 mol G和1.20 mol H2O,到达平衡时,
n(D)= mol。
③ 温度升至800℃,上述反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热”)。
(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率vA vC(
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率vA vC( 同上)。
同上)。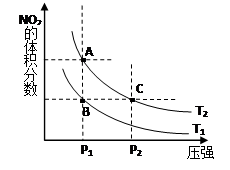
(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 ;
②该反应的平衡常数K的值为 ;
③若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是 mol/L。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为 ;(结果保留小数点后一位)
(每空2分共8分)
向体积不变的密闭容器中充入2 mol N2和6 mol H2,一定条件下发生反应:
N2(g)+ 3 H2(g) 2 NH3(g),平衡时混合气体共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
2 NH3(g),平衡时混合气体共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
①.若a=0,b=0,则c=
②.若a=0.7,b=2.1,则:
Ⅰ.c= .
Ⅱ.这时反应向 进行.
Ⅲ.若要维持反应开始向该反应方向进行,c的范围是
在100℃和200kPa的条件下,反应aA(g)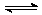 bB(g)+c C(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度。
bB(g)+c C(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度。
| 压强(kPa) |
200 |
500 |
1000 |
| B的浓度(mol/L) |
0.04 |
0.1 |
0.27 |
根据表中的数据,回答下列问题:
(1)压强从200kPa增加到500kPa时,平衡 移动(填“正向”或“逆向”或“不”),理由是 。
(2)压强从500kPa增加到1000kPa时,平衡 移动(填“正向”或“逆向”或“不”),其原因可能为 。
尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1
H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
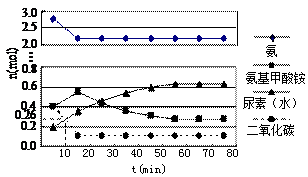 |
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol 氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
图Ⅰ 图Ⅱ
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 ▲ 步反应决定,总反应进行到 ▲ mi n时到达平衡。
n时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)= ▲ 。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 ▲ 0(填“>”“<”或“=”)
在一定温度下,向一个容积不变的密闭容器中加入 2 molA 和 2 molB ,发生反应:2A(g) + B(g) 3C( g) ΔH=-a kJ/mol(a>0),达到平衡时放出的热量为 bkJ,B的体积分数为ω1%。试回答:
3C( g) ΔH=-a kJ/mol(a>0),达到平衡时放出的热量为 bkJ,B的体积分数为ω1%。试回答:
(1)该反应平衡常数K表达式为________________________。 a与b的关系是a b(填“>”、“<”、“=”)。
(2)若升高温度,平衡常数K__________(填“增大”、“减小”或“不变”,下同),达到平衡时B的体积分数_________。
(3)下列说法中能表明该反应已达到平衡状态的是_________。
| A.温度和体积一定时,容器内压强不再变化 |
| B.温度和体积一定时,某一物质浓度不再变化 |
| C.条件一定,混合气体的平均相对分子质量不再变化 |
| D.温度和压强一定时,混合气体的密度不再变化 |
(4)若向上述平衡体系中再充入1 molB 和3 molC,在相同条件下达到平衡时B的体积分数为ω2 %,则ω1% ω2 % (填“>”、“ =”或“<”),理由是 。
试题篮
()