H2A(酸):K1=4.310-6,K2=2.110-9。H2B(酸):K1=1.010-4,K2=6.310-8,在浓度相同的对应溶液中,用“>”、“<”或“=”填空。
(1)中和同浓度、同体积NaOH溶液时的用量:H2A溶液________H2B溶液;
(2)c (Na+):Na2A溶液________Na2B溶液;
(3)pH:H2A溶液________H2B溶液;
(4)酸分子的浓度:NaHA溶液________NaHB溶液;
(5) 酸根离子的浓度:NaHA溶液________NaHB溶液;
在具有活塞的密闭容器中,一定温度下的可逆反应:

 已达到平衡。将活塞外拉,则:
已达到平衡。将活塞外拉,则:
①容器内颜色 ②容器内压强
③逆反应速率 ④混合气体平均分子质量
(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率vA vC(
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率vA vC( 同上)。
同上)。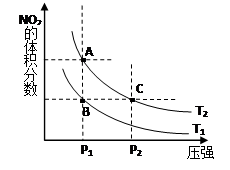
(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 ;
②该反应的平衡常数K的值为 ;
③若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是 mol/L。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为 ;(结果保留小数点后一位)
I.现有下列物质:
1、CI2 2、Na2O2 3、NaOH 4、HCl 5、H2O2 6、MgF2 7、Mg3N2
(1)只有离子键构成的物质是 (2)只有极性键构成的物质是
(3)只有非极性键构成的物质 (4)有极性键和非极性键构成的物质是
(5)有离子键和极性键构成的物质是(6)有离子键和非极性键构成的物质是
(7)属于离子化合物的是 (8)属于共价化合物的是
II.能够说明可逆反应2NO2 N2O4达到平衡状态的标志是_____________
N2O4达到平衡状态的标志是_____________
①单位时间消耗2mol NO2的同时,生成1 mol N2O4 ②恒温恒压下,混合气体的密度不变 ③NO2和N2O4的浓度之比为2∶1 ④混合气体的颜色不变 ⑤单位时间消耗4mol NO2的同时,消耗2mol N2O4
I. 恒温、恒压下,在一个容积可变的容器中发生如下反应: A(g)+B(g)  C(g)
C(g)
(1)若开始时放入1molA和1molB,到达平衡后,生成a mol C,这时A的物质的量
为_____mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x mol A、2molB和l mol C,到达平衡后,A和C的物质的量分别
是y mol和3a mol,则x ="_____mol," y =_____mol。平衡时,B的物质的量_____(选
填一个编号)。
(甲)大于2mol (乙)等于2mol
(丙)小于2mol (丁)可能大于、等于或小于2mol。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是
________。
II. 若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入l mol A和l mol B到达平衡后生成b mol C。将b与(1)小题中的a进
行比较________________ (选填一个编号)。
(甲)a < b (乙) a > b (丙) a =" b " (丁) 不能比较a和b的大小。
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:
(1)该反应的化学方程式为 ;
(2)从开始至2min,Z的平均反应速率为 ;
(3)若X、Y、Z均为气体,反应达平衡时:
此时体系的压强是开始时的 倍
在100℃和200kPa的条件下,反应aA(g) bB(g)+c C(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度。
bB(g)+c C(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度。
| 压强(kPa) |
200 |
500 |
1000 |
| B的浓度(mol/L) |
0.04 |
0.1 |
0.27 |
根据表中的数据,回答下列问题:
(1)压强从200kPa增加到500kPa时,平衡 移动(填“正向”或“逆向”或“不”),理由是 。
(2)压强从500kPa增加到1000kPa时,平衡 移动(填“正向”或“逆向”或“不”),其原因可能为 。
下表是元素周期表的一部分:
族 |
I A |
II A |
III A |
IV A |
V A |
VI A |
VII A |
||
| 2 |
② |
③ |
④ |
|
⑤ |
⑥ |
|
||
| 3 |
⑦ |
⑧ |
⑨ |
|
⑩ |
 |
 |
(1)表中元素⑩的氢化物的化学式为___________,此氢化物的还原性比元素 的氢化物的还原性______稳定性 (填强或弱)
的氢化物的还原性______稳定性 (填强或弱)
(2)某元素的原子结构示意图为: ,在周期表位于 。该
,在周期表位于 。该
氢化物沸点比甲烷 (填高或低)。
(3)用电子式表示 与⑧形成化合物形成过程: 。
与⑧形成化合物形成过程: 。
(4)写出⑦与⑨、⑨与 的最高价氧化物对应水化物反应的离子方程式:
的最高价氧化物对应水化物反应的离子方程式:
⑦与⑨: 、⑨与 。
。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上利用煤的汽化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的汽化的主要化学方程式为 。
(2)利用水煤气合成二甲醚的总反应式可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H< 0。一定条件下得密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(g)+CO2(g) △H< 0。一定条件下得密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
| A.高温高压 | B.加入催化剂 |
| C.减少CO2的浓度 | D.增加CO的浓度 E.分离出二甲醚 |
(3)已知反应2CH3OH(g)  CH3OCH3(g)+H2O(g),某温度下得平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),某温度下得平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol/L) |
0.44 |
0.6 |
0.6 |
①通过计算比较此时正、逆反应速率的大小?
②若加入CH3OH后,经10min反应达到平衡,试计算此时CH3OH的物质的量浓度和该时间内CH3OH的化学反应速率?
在一定温度下,向一个容积不变的密闭容器中加入 2 molA 和 2 molB ,发生反应:2A(g) + B(g) 3C( g) ΔH=-a kJ/mol(a>0),达到平衡时放出的热量为 bkJ,B的体积分数为ω1%。试回答:
3C( g) ΔH=-a kJ/mol(a>0),达到平衡时放出的热量为 bkJ,B的体积分数为ω1%。试回答:
(1)该反应平衡常数K表达式为________________________。 a与b的关系是a b(填“>”、“<”、“=”)。
(2)若升高温度,平衡常数K__________(填“增大”、“减小”或“不变”,下同),达到平衡时B的体积分数_________。
(3)下列说法中能表明该反应已达到平衡状态的是_________。
| A.温度和体积一定时,容器内压强不再变化 |
| B.温度和体积一定时,某一物质浓度不再变化 |
| C.条件一定,混合气体的平均相对分子质量不再变化 |
| D.温度和压强一定时,混合气体的密度不再变化 |
(4)若向上述平衡体系中再充入1 molB 和3 molC,在相同条件下达到平衡时B的体积分数为ω2 %,则ω1% ω2 % (填“>”、“ =”或“<”),理由是 。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。
(1)在250C、101KPa时,3.2克甲醇(CH30H)完全燃烧生成CO2和液态水时放热72.576kJ,则能表示甲醇燃烧的热化学方程式为___________________。
(2)为探究反应原理,现进行如下实验,在体积为2 L的密闭容器中,充入2mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=—49kJ/mol,测得CO2和H2O (g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=—49kJ/mol,测得CO2和H2O (g)的浓度随时间变化如图所示。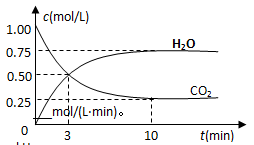
①从反应开始到平衡,氢气的平均反应速率v(H2)=__________mol/(L·min)。
②下列措施中能使n(H2O)/n(CO2)增大的是________。
A.升高温度 B.再充入3mol H2
C.将CH3OH (g)从体系中分离 D.充入He(g),使体系压强增大
反应m A+n B p C在某温度下达到平衡。
p C在某温度下达到平衡。
(1)若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的
关系是 。
(2)若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向_____
方向移动。
(3)如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为___态。
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看做是化学平衡的一种。请根据所学化学知识回答下列问题:
Ⅰ、已知0.01mol/L的NaHCO3溶液呈碱性。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ② 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)该溶液中的离子浓度由大到小的顺序是: 。
(4)向该溶液中加入AlCl3溶液,有白色胶状 沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式: 。
沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式: 。
Ⅱ、有盐酸、硫酸、醋酸三种溶液,试回答:
(1)若三种溶液的浓度均为0.1 mol•L-1,其c(H+) 依次为a mol•L-1,b mol•L-1,c mol•L-1,其大小顺序为 ;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为 。
(2)若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH1、pH2、pH3之间的关系为 (用“<”、“>”或“=”表示,pH1 ——代表盐酸、 pH2 ——代表硫酸、pH3 ——代表醋酸)
Ⅲ、已知含有足量AgCl固体的饱和溶液中存在如下平衡:AgCl(s) Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水
Ag+(aq)+Cl-(aq),且在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl固体分别放入下列液体中:①100mL蒸馏水
②100mL0.3mol/L AgNO3溶液 ③100mL0.1mol/L MgCl2溶液充分搅拌后冷却到25℃时,此时c(Ag+)由大到小的顺序为 (填序号),溶液②中c(Cl-)= 。
向体积为10 L的固定密闭容器中通入3 mol X气体,在一定温度下发生如下反应:
2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡Ⅰ,此时测得容器内的压强为起始时的1.2倍,则且Y表示的反应速率为 mol/(L·min);
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内反应速率分别为:甲: 丙:
丙: 。若其它条件下同,温度不同,则温度由高到低的顺序是(填序号) ;
。若其它条件下同,温度不同,则温度由高到低的顺序是(填序号) ;
(3)若向Ⅰ的平衡体系中充入氮气,则平衡 (填“向左”或“向右”或“不”)移动;若将Ⅰ的平衡体系中部分混合气体移走,则平衡 (填“向左”或“向右”或“不”)移动;
(4)若在相同条件下向Ⅰ的平衡体系中再充入0.5 mol X气体,则原平衡Ⅰ中X的转化率与重新平衡后X的转化率相比较 (选填字母)。
| A.无法确定 | B.前者一定大于后者 |
| C.前者一定等于后者 | D.前者一定小于后者 |
(5)若保持温度不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时各气体体积分数与Ⅰ平衡相同,且起始时维持化学反应向逆反应方向进行。则c的取值范围应该为 。
试题篮
()