80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4  2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
110 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算20s—40s内用N2O4表示的平均反应速率为 mol/(L.s)
②计算在80℃时该反应的N2O4的转化率= 此温度下
③反应进行至110s后将反应混合物的温度降低,混合气体的颜色 ;如果此时加入NO2,则此时容器内颜色 (填“变浅”、“变深”或“不变”)
④要增大该反应NO2的体积分数,可采取的措施有(填序号)
A.增大N2O4的起始浓度 B.通入N2气体
C.使用高效催化剂 D.升高温度
830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
试回答下列问题:
(1)若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为50%,则在该温度下,该反应的平衡常数K= .
(2)在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),你判断的依据是
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
高炉炼铁过程中发生的主要反应为:
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下表:请回答下列问题:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
(1)该反应的平衡常数表达式K=________,ΔH________0 ( 填“>”.“<”或“=” );
(2)在体积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。该时间范围内反应的平均反应速率v(CO2)= ,CO的平衡转化率为 。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A 减少Fe的量 B 增加Fe2O3的量 C 移出部分CO2
D 提高反应温度 E 减小容器的容积 F 加入合适的催化剂
铁及其化合物与生产、生活关系密切。
(1)写出铁红(Fe2O3)的一种用途: 。
(2)写出利用FeCl3溶液制备氢氧化铁胶体的离子方程式: ;
(3)已知t℃时,FeO(s)+CO(g)  Fe(s)+CO2(g)的平衡常数K=0.25,在该温度下,反应达到平衡时n(CO):n(CO2)=
Fe(s)+CO2(g)的平衡常数K=0.25,在该温度下,反应达到平衡时n(CO):n(CO2)=
利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)  5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4 molCO,测得CO2的体积分数随时间t变化曲线如图。请回答:
5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通人4 molCO,测得CO2的体积分数随时间t变化曲线如图。请回答:
(1)T2时,0~0.5min内的反应速率v(CO)=___________。
(2)T1时化学平衡常数K=______________。
(3)下列说法不正确的是_______(填字母序号)。
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,C点时体系中混合气体的压强相等 |
| C.d点时,增大体系压强,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb<Kd |
在具有活塞的密闭容器中,一定温度下的可逆反应,H2(g)+I2(g) 2HI(g)已达平衡,将活塞外拉,在此过程中:
2HI(g)已达平衡,将活塞外拉,在此过程中:
(1)容器颜色 (填“变浅”或“变深”)
(2)容器内的压强 (填“变大”“变小”或“不变”)
(3)混合气体的密度 (填“变大”“变小”或“不变”
(1)①1 g 硫粉在O2中充分燃烧放出 a kJ热量,写出硫燃烧的热化学方程式 。
②已知25℃时,C2H5OH(l)的燃烧热为1366.8kJ/mol,用热化学方程式表示:
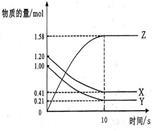
(2)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线图如下图示,则①在10S内Z的平均速率为 ②该反应的化学方程式 。
在一定条件下,xA+yB zC的反应达到平衡。
zC的反应达到平衡。
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则向 移动。(填“正”、“逆”、“无法判断”)
(3)已知B、C是气体,当其他条件不变,增大A的物质的量时,平衡不移动,则A是 态。(填“气”、“液”、“固”)
(4)加热后C的质量分数减少,则正反应是 热反应。
在一定条件下,可逆反应:mA+nB pC达到平衡状态。
pC达到平衡状态。
(1)若A、B、C都是气体,减小压强,平衡向正反应方向移动,则m+n和p的关系是________。
(2)若A、C是气体,增加B的量,平衡不移动,则B的状态为______________。
(3)若A、C是气体,而且 m+n=p,增大压强可使平衡发生移动,则平衡向________(填“正”或“逆”)反应方向移动。
(4)若加热后,可使C的质量增加,则正反应是________(填“放热”或“吸热”)反应。
(1)在某压强恒定的密闭容器中加入2 molN2和4 molH2发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol,当反应建立平衡时,此时容器体积为反应前的三分之二。则:
2NH3(g);ΔH=-92.4 kJ/mol,当反应建立平衡时,此时容器体积为反应前的三分之二。则:
①达到平衡时,N2的转化率为___________。
②若向该容器中加入a mol N2、b mol H2、c mol NH3,在相同条件下达到平衡时,混合物中各组分的百分含量与上述平衡相同,则a 、b、c应满足的关系为 。
(2)若将2 molN2和4 molH2放入起始体积相同的恒容容器中,在与(1)相同的温度下达到平衡,则平衡时NH3的浓度 (1) (2) (填“>”、“<”或“=”)。
(3)常温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL 0.10mol/L HCl溶液和20.00 mL 0.10 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示:
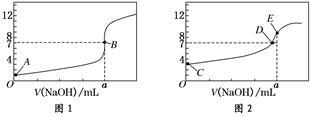
①NaOH溶液滴定HCl溶液的曲线是 (填“图1”或“图2”);
②图中c(Na+)=c(CH3COO-)的点是 (填A、B、C、D或E);
③滴定结束,经数据处理后发现a大于20.00ml,请你分析该同学测定a值偏大的原因可能是 。
在某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为_____________。在该温度下,此化学反应的平衡常数表达式为_______________。
(2)反应开始至5min,Y的转化率为____________。
(3)在其他条件不变的情况下,如果起始充入X、Y、Z的物质的量分别为4mol、6mol、2mol,则此反应向___________(填“正反应”,“逆反应”)方向进行。
反应A(g)+ B(g) C(g) +2D(g)的能量变化如下图所示,回答下列问题。
C(g) +2D(g)的能量变化如下图所示,回答下列问题。
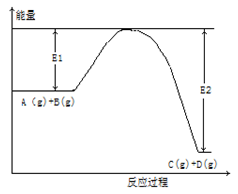
(1)该反应是 反应(填“吸热”“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”“减小”“不变”下同),原因是 ;
(3)向体系中加入催化剂,△H ;
(4)将1molA和2molB加入2L容器中,5min后达到平衡,此时A的转化率为50%,则5min内用D表示化学反应速率为 ,平衡常数K= 。
研究NO2、SO2、CO等大气污染气体的处理具有重大意义。
(1)NO2可用水吸收,相应的化学反应方程式为_________________________;利用反应6NO2+8NH3═7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是____________L。
(2)已知:
2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)⇌2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的△H="_______" kJ•mol-1
(3)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_______(填序号)
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=_______。
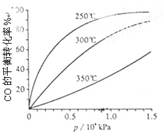
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)═CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如下图所示.该反应△H_____(填“>”或“<”),实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是_______。
对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) 按题目的要求写出可能采取的措施。
pC(g)+qD(g) 按题目的要求写出可能采取的措施。
(1)正、逆反应速率都改变,但平衡不移动,则改变的条件可能是:① ,②若 ,则改变的条件是压强。
(2)只改变正反应速率或只改变逆反应速率,则改变的条件可能是单独改变 或是单独改变 。
(3)正、逆反应速率发生不同程度的变化,则改变的条件可能是:① ,②若 ,则改变的条件是压强。
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:N2O5(g) 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达平衡后,再通入一定量N2O5,则N2O5的转化率将_______。(填““增大”“减小”或“不变”);
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1 000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为_________________。
③在T2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2___________T1。
(2)下图所示装置可用于制备N2O5,则N2O5在电解池的_________区生成,其电极反应式为_________________。
试题篮
()