材料是人类赖以生存和发展的重要物质基础,铁和碳是生活中常见的材料。
(1)碳可用于制取水煤气:C(s)+H2O(g)=CO(g)+H2(g)。相同温度下,在体积均为2L的两个密闭容器(已加入足量的碳)中进行上述反应,反应容器分别用编号A、B表示。
①写出该反应的平衡常数的表达式:
②已知该温度下平衡常数K="1.5" mol·L-1,若向A容器中另加入一定量的水蒸气,经过一段时间后达到平衡,此时c(H2O)=0.1mol·L-1、c(CO)=0.5mol·L-1,则c(H2)= mol·L-1。
③若向B容器中再加入一定量的水蒸气,某一时刻测得体系中物质的量如下:n(H2O)=0.2mol、n(CO)=0.2mol、 n(H2)=0.8mol则此时该反应
(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
(2)钢铁在海水中常发生电化学腐蚀,其负极反应式为 ;
(3)利用右图装置,可以模拟铁的电化学防护,为减缓铁的腐蚀,若开关K置于b处则Fe应与电源的 极相连。若开关置于a处,则下列可用作X极材料的是 。
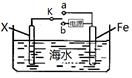
A.Zn B.Cu C.石墨 D.Pt
在一定条件下,可逆反应:mA+nB pC达到平衡状态。
pC达到平衡状态。
(1)若A、B、C都是气体,减小压强,平衡向正反应方向移动,则m+n和p的关系是________。
(2)若A、C是气体,增加B的量,平衡不移动,则B的状态为________。
(3)若A、C是气体,而且 m+n=p,增大压强可使平衡发生移动,则平衡向________(填“正”或“逆”)反应方向移动。
(4)若加热后,可使C的质量增加,则正反应是________(填“放热”或“吸热”)反应。
(1)镍氢碱性充电电池被誉为“绿色化学电源”,充、放电时的反应:
2Ni(OH)2 2NiO(OH) + H2放电时,正极的电极反应式为 ,充电时,该电极应与电源的 (填“正”或“负”)极相连。
2NiO(OH) + H2放电时,正极的电极反应式为 ,充电时,该电极应与电源的 (填“正”或“负”)极相连。
(2)氨在空气中燃烧,生成水和氮气。已知:N2(g)+3H2(g)  2NH3(g) △H= —92.4kJ·mol-1, 2H2(g)+O2(g)
2NH3(g) △H= —92.4kJ·mol-1, 2H2(g)+O2(g) 2H2O(l) ΔH="-572" kJ·mol-1,则氨在空气中燃烧生成液态水和氮气时的热化学方程式为: 。
2H2O(l) ΔH="-572" kJ·mol-1,则氨在空气中燃烧生成液态水和氮气时的热化学方程式为: 。
(3)研究表明工业上合成氨反应(N2(g)+3H2(g)  2NH3(g))在容积固定的密闭容器中发生上述反应,表一中为各物质在不同时刻的浓度。
2NH3(g))在容积固定的密闭容器中发生上述反应,表一中为各物质在不同时刻的浓度。
| 时间/min |
c(N2)/mol·L-1 |
c(H2) /mol·L-1 |
c(NH3) /mol·L-1 |
| 0 |
0.6 |
1.8 |
0 |
| 5 |
0.48 |
X |
0.24 |
| 10 |
0.26 |
0.78 |
0.68 |
表一
0~5 min,H2的平均反应速率vH2= 。反应在5分钟时,条件发生了改变,改变的条件可能是 (填序号)。
a.增加氢气的浓度 b.降低温度 c.使用催化剂 d.分离出NH3
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g) CO(g)+H2(g) ΔH="+131.3" kJ•mol-1,ΔS=+133.7J•(K•mol) -1
CO(g)+H2(g) ΔH="+131.3" kJ•mol-1,ΔS=+133.7J•(K•mol) -1
①该反应能否自发进行与 有关。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)
a.容器中的压强不变
b.1 mol H—H键断裂的同时断裂2 molH—O键
c.υ正(CO) =υ逆(H2O)
d.c(CO)=c(H2)
下图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
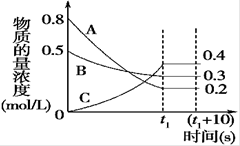
(1)该反应的化学方程式为 。
(2)0~t1s 内B气体的平均反应速率为 。
(3)(t1+10)s 时,A的转化率为 ,此时v(A)正 v(B)逆(填“>”、“<”或“=”)。
(4)关于该反应的说法正确的是 。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为 。
合成氨对化学工业和国防工业有重要意义。若向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)关系图。
(1)图A中压强为10 MPA时,N2的转化率为
(2)已知:在合成氨反应中,升高温度H2的转化率降低。
①若图B中T=450℃,则温度为500℃时对应的曲线是 (填“A”或“B”)
②该反应达到平衡时某物理量随温度变化如下图所示,纵坐标可以表示的物理量有 
| A.H2的逆反应速率 |
| B.N2的质量百分含量 |
| C.NH3的的体积分数 |
| D.混合气体的平均相对分子质量 |
有如下化学反应:2A(g)+B(g) 2C(g),△H<0。
2C(g),△H<0。
(1)若将4 mol A和2 mol B在2 L的容器中混合,经2 s后测得C的浓度为0.6 mol/L,用物质A表示的平均反应速率为_____;2s时物质B的浓度为__________;
(2)若将4 mol A和2 mol B加入体积不变的容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2 mol。此时,混合气体中C的体积分数为__________;若再通入少量B气体,体系中A的物质的量_________(填“增大”、“减小”或“不变”),若要使A的物质的量再达到与原平衡状态相同,可采取的三种措施有 、 、
在一定条件下xA+yB zC达到平衡时,请填写:
zC达到平衡时,请填写:
(1)若A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z关系是___________________。
(2)已知B、C是气体,现增加A的物质的量,平衡不移动,说明A是_________________(填状态)。
(3)若容器容积不变,加入气体B,气体A的转化率__________(填“增大”“减小”或“不变”)。
(4)若加热后,C的百分含量减小,则正反应是___________反应(填“放热”或“吸热”)。
(5)若容器容积不变,且A、B、C都是气体,向容器中充入稀有气体,则 。
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不移动 D.反应停止
(1)在某压强恒定的密闭容器中加入2 molN2和4 molH2发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol,当反应建立平衡时,此时容器体积为反应前的三分之二。则:
2NH3(g);ΔH=-92.4 kJ/mol,当反应建立平衡时,此时容器体积为反应前的三分之二。则:
①达到平衡时,N2的转化率为___________。
②若向该容器中加入a mol N2、b mol H2、c mol NH3,在相同条件下达到平衡时,混合物中各组分的百分含量与上述平衡相同,则a 、b、c应满足的关系为 。
(2)若将2 molN2和4 molH2放入起始体积相同的恒容容器中,在与(1)相同的温度下达到平衡,则平衡时NH3的浓度 (1) (2) (填“>”、“<”或“=”)。
(3)常温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL 0.10mol/L HCl溶液和20.00 mL 0.10 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示:
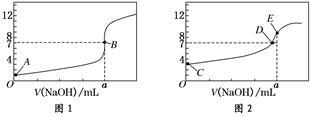
①NaOH溶液滴定HCl溶液的曲线是 (填“图1”或“图2”);
②图中c(Na+)=c(CH3COO-)的点是 (填A、B、C、D或E);
③滴定结束,经数据处理后发现a大于20.00ml,请你分析该同学测定a值偏大的原因可能是 。
在某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为_____________。在该温度下,此化学反应的平衡常数表达式为_______________。
(2)反应开始至5min,Y的转化率为____________。
(3)在其他条件不变的情况下,如果起始充入X、Y、Z的物质的量分别为4mol、6mol、2mol,则此反应向___________(填“正反应”,“逆反应”)方向进行。
反应A(g)+ B(g) C(g) +2D(g)的能量变化如下图所示,回答下列问题。
C(g) +2D(g)的能量变化如下图所示,回答下列问题。
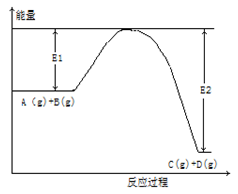
(1)该反应是 反应(填“吸热”“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”“减小”“不变”下同),原因是 ;
(3)向体系中加入催化剂,△H ;
(4)将1molA和2molB加入2L容器中,5min后达到平衡,此时A的转化率为50%,则5min内用D表示化学反应速率为 ,平衡常数K= 。
研究NO2、SO2、CO等大气污染气体的处理具有重大意义。
(1)NO2可用水吸收,相应的化学反应方程式为_________________________;利用反应6NO2+8NH3═7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是____________L。
(2)已知:
2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)⇌2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的△H="_______" kJ•mol-1
(3)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_______(填序号)
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=_______。
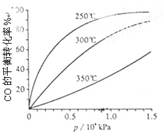
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)═CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如下图所示.该反应△H_____(填“>”或“<”),实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是_______。
对于平衡体系mA(g)+nB(g)  pC(g)+qD(g) 按题目的要求写出可能采取的措施。
pC(g)+qD(g) 按题目的要求写出可能采取的措施。
(1)正、逆反应速率都改变,但平衡不移动,则改变的条件可能是:① ,②若 ,则改变的条件是压强。
(2)只改变正反应速率或只改变逆反应速率,则改变的条件可能是单独改变 或是单独改变 。
(3)正、逆反应速率发生不同程度的变化,则改变的条件可能是:① ,②若 ,则改变的条件是压强。
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:N2O5(g) 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达平衡后,再通入一定量N2O5,则N2O5的转化率将_______。(填““增大”“减小”或“不变”);
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1 000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为_________________。
③在T2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2___________T1。
(2)下图所示装置可用于制备N2O5,则N2O5在电解池的_________区生成,其电极反应式为_________________。
下表是元素周期表的一部分,针对a~k十一种元素回答下列问题(请用具体化学式回答,否则不给分):
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 2 |
a |
c |
d |
|
e |
f |
g |
| 3 |
b |
h |
i |
|
|
j |
k |
(1)这些元素中非金属性最强的单质是 ,最高价氧化物对应水化物酸性最强的是 ,最高价氧化物对应水化物碱性最强的是 。
(2)表中k的氢化物的化学式为 ,它的还原性比j的氢化物还原性 (填“强”或“弱”),它水溶液的酸性比j的氢化物水溶液的酸性 (填“强”或“弱”)。
(3)e单质为 ,其结构式为 。
(4)用电子式表示h与k构成化合物的形成过程
(5)写出i的氧化物与强碱溶液反应的离子方程式
(6)H2和e的单质化合的反应是可逆反应,且该反应正方向放热。将等物质的量的H2、e的单质充入一恒容密闭容器中,在适当条件下反应。下列说法正确的是 (填写选项)。
A.升高温度,不论正反应方向还是逆反应方向速率都加快
B.向上述容器中充入适量Ar气可加快反应速率
C.反应过程中,e的单质的体积分数始终为50%
D.反应器内压强不随时间变化而变化,说明反应到达平衡
试题篮
()