(6分)现有反应:CO(g)+ H2O(g) CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
(1)若升高温度到950℃时,达到平衡时K_____1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2 和 x molH2,则:
①当x=5.0时,上述平衡向_______(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的热值分别为143kJ· g-1、10kJ·g-1和23kJ·g-1。请回答下列问题:
(1)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_ ______;
(2)在直接以甲醇为燃料电池中,电解质溶液为碱性,负极的反应式为_____ , 总反应式 。
(3)在350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒容器中,充分反应生成甲醇蒸汽和水蒸气达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;若350℃时,保持温度不变,将1molCO2和3molH2充入一密闭恒压器中,充分反应达到平衡后,若CO2转化率为b,则a b(用“>、=、<”表示)
在一个固定体积的密闭容器中发生某反应,当改变其他反应条件,在I、II、III阶段,体系中各物质浓度随时间变化的曲线如下图所示:
(1)该反应的化学方程式为 (物质用图中的“A”、“B”、“C”表示),该反应在第I阶段的平衡常数为 。
(2)第III阶段,从开始至平衡,用B表示的平均反应速率为 ;
(3)第I阶段,A的转化率为 ;第III阶段达平衡后,C的体积分数为 ;
(4)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(5)已知第Ⅱ阶段反应温度(T2)低于第III阶段反应温度(T3),则该反应的正反应
△H 0(填“<”或“>”)
氨在国民经济中占有重要的地位,2008年,我国氨产量接近500万吨。下图是合成氨的简要流程。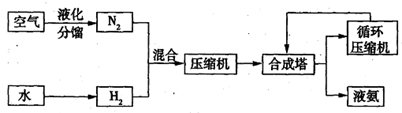
(1)天然气、重油、煤都可以与水反应制得氢气。下表是某合成氨厂采用不同原料的相对投资和能量消耗。
| 原料[ |
天然气 |
重油 |
煤 |
| 相对投资费用 |
1.0 |
1.5 |
2.0 |
| 能量消耗/J·t—1 |
28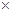 109 109 |
38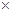 109 109 |
48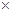 109 109 |
①依据上表信息,你认为采用 为原料最好。
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式: 。
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)===CO2(g) △H=-394kJ·mol—1;
2CO(g)+O2(g)===2CO2(g)△H=-566kJ·mol—1;
2H2(g)+O2(g)===2H2O(g)△H="-484" kJ·mol—1;
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式 。
(2)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据。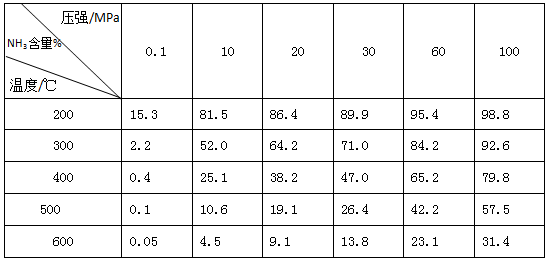
①依据表中数据判断,合成氨反应N2+3H2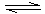 NH3的△H 0(填“>”、“<”或“无法判断”
NH3的△H 0(填“>”、“<”或“无法判断” ,请简要说明理由 ;
,请简要说明理由 ;
②该反应的化学平衡常数表达式为 。
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的 倍。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)写出CO燃烧的热化学方程式_____ ________;
(2)写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);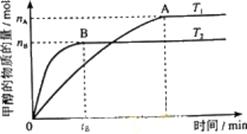
①温度升高该反应的平衡常数 (增大、减小、不变)
②B过程用H2表示该反应的化学反应速率是 mol·L-1·min-1
(4)在直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-==CO32-+3H2O,负极的反应式为 。
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)  CO(g)+H2O(g),其平衡常数K与温度t的关系如下表:
CO(g)+H2O(g),其平衡常数K与温度t的关系如下表:
| T |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
在此温度下,若该容器中含有1molCO2、 1.2molH2、 0.75molCO、 1.5molH2O,这状态 (是或否)处于平衡状态?若不是,反应向哪个方向进行?
恒温、恒压下,在一个可变容积的容器中发生如下反应:A(g)+B(g)  C(g)
C(g)
(1)若开始时放入1 mol A+1 mol B,到达平衡后,生成a mol C,这时A的物质的量为________ mol.
(2)若开始时放入3 mol A和3 mol B,到达平衡后,生成C的物质的量为________ mol.
(3)若开始时放入x mol A,2 mol B和1 mol C,到达平衡后,A和C的物质的量分别为y mol和3a mol,则x=________mol,y=________mol.平衡时,B的物质的量________(选填一个编号).
(甲)大于2 mol (乙)等于2 mol (丙)小于2 mol (丁)可能大于、等于或小于2 mol
(4)若在(3)的平衡混合物中再加入3 mol C,待再次达到平衡后,C的物质的量分数是________.
在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |

(1)写出该反应的平衡常数表达式:K=________。已知:K300 ℃>K350 ℃,则该反应是________热反应。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=_____ ___。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向逆反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g) + 3H2(g)  2NH3(g);ΔH =" -92.2" kJ·mol-1。
2NH3(g);ΔH =" -92.2" kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t2 ﹑t4 ﹑t5﹑t7时刻所对应的实验条件改变分别是
t2 t4 t5 t7 。
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为 。
(2)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入1mol及2mol碘化氢待反应:2HI(g) H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A c(I2)B ;平衡时HI的分解率αA αB ;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)
H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A c(I2)B ;平衡时HI的分解率αA αB ;平衡时H2在混合气体中的体积分数A B (填写“>”“<”“=”)
在一个2L的密闭容器中,发生反应:2SO3 (g) 2SO2+ O2 △H>0,其中SO3的变化如下图示:
2SO2+ O2 △H>0,其中SO3的变化如下图示: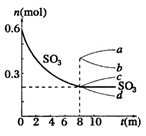
(1)写出该反应的平衡常数表达式: ________________ ,
(2)用O2表示从0~8min内该反应的平均速率v= 。
(3)升高温度,该反应的反应速率将 ;K值将_______;容器中气体的平均相对分子质量将____ 。(填:“增大”,“减小”或“不变”)
(4)能说明该反应已达到平衡状态的是 。
a.v(SO3)=2v(O2) b.容器内压强保持不变 c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(5)从8min起,压缩容器为1L,则SO3的变化曲线为
| A.a | B.b | C.c | D.d |
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0[ |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)= υ逆(H2O) d.c(CO2)= c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)= c(CO)·c(H2O),试判断此时的温度为 ℃。
(12分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g) CO(g)+3H2(g) ⊿H1="+206.1" kJ/mol
CO(g)+3H2(g) ⊿H1="+206.1" kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g) ⊿H2="+247.3" kJ/mol
2CO(g)+2H2(g) ⊿H2="+247.3" kJ/mol
③CO(g)+H2O(g) CO2(g)+ H2(g) ⊿H3
CO2(g)+ H2(g) ⊿H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得 的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是 。
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的 和
和 ,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中
,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中 的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中
的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中 的转化率随时间变化的图像。
的转化率随时间变化的图像。
(3)反应③中 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应③中正、逆反应速率的关系式是 (填代号)。
a. (正)
(正) (逆) b.
(逆) b. (正)<
(正)< (逆) c.
(逆) c. (正)=
(正)= (逆) d.无法判断
(逆) d.无法判断
(4)800K时下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,其反应是2SO2(g)+O2(g)  2SO3(g);△H=-96.56 kJ•mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
2SO3(g);△H=-96.56 kJ•mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
【1】达到平衡时,平衡常数K (甲) K (乙) K(丙)(填“>”、“<”或“=”)。
【2】达到平衡时SO2的浓度C(SO2)(甲) C(SO2) (乙) C(SO2) (丙)(填“>”、“<”或“=”)。
、已知可逆反应: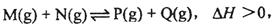
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol,L-1, c(N)="2.4" mol·L-1; 达到平衡后,M的转化率为60%,此时N的转化率为 ;
(2)若反应温度升高,M的转化率 (填“增大”、“减小”或“不变”;)
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 4mol,L-1, c(N)="a" mol·L-1;达到平衡后,c(P)="2" mol·L-1,a= (要求写出计算过程) ;
(4)若反应温度不变,反应物的起始浓度为:c(M)=" c(N)=b" mol,L-1,达到平衡后,M的转化率为
(要求写出计算过程)。
(14分) 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化
CO(g)+H2O(g),其化
学平衡常数K与温度t的关系如下:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答下列问题:(1)该反应的化学平衡常数K = 。
(2)该反应为 反应。(填“吸热”或“放热”)
(3)800℃,固定容积的密闭容器中,放入混合物,起始浓度为c(CO)="0.01" mol/L, c(H2O)="0.03" mol/L, c(CO2)="0.01" mol/L, c(H2)="0.05" mol/L ,则反应开始时,H2O的消耗速率比生成速率 (填“大”、“小”或“不能确定”)
(4)830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为 , H2的转化率为 。
下列反应在210℃时达到平衡:
①PCl5(g) PCl3(g)+Cl2(g);△H1>0 K1=1mol·L—1
PCl3(g)+Cl2(g);△H1>0 K1=1mol·L—1
②CO(g)+Cl2(g) COCl2(g);△H2<0 K2=5×104L·mol—1
COCl2(g);△H2<0 K2=5×104L·mol—1
③COCl2(g) CO(g)+Cl2(g)△H3 K3
CO(g)+Cl2(g)△H3 K3
④2SO2(g)+O2(g) 2SO3(g);△H4<0
2SO3(g);△H4<0
(1)反应③的平衡常数K3为 。
(2)要使反应①和反应②的K数值相等,可采取的措施是 (填序号)。
A.降低反应①、②体系中Cl2浓度 B.反应①、②选择不同的催化剂
C.反应①、反应②同时升高温度 D.反应①、反应②同时降低温度
E.反应①降低温度,反应②维持210℃
(3)在甲、乙两容器中分别发生反应④,甲恒容、乙恒压,温度相同且恒定。起始时甲中加入0.02molSO2和0.01molO2,乙中加入0.02molSO3气体,开始时两容器压强相等,最后分别达到平衡。下列有关它们达到平衡状态后的叙述正确的是 (填序号)。
A.体积:甲可能小于乙 B.SO3的物质的量:甲一定小于乙
C.压强:甲可能大于乙 D.浓度比c(SO2)/c(SO3):甲一定小于乙
(4)丙容器为容积不变的反应容器,要求通过调节体系的温度使反应④达到平衡时,保持容器内气体总物质的量为15mol。现向容器中加入xmolSO2,6.5mol O2,2.0molSO3。
①若x=5.5,需要 (填“降低”“升高”或“保持”)体系温度,使反应在平衡时达到题设要求;
②欲使起始反应维持向逆反应方向移动,则x的取值范围为 。
试题篮
()