向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g) pC(g)+qD(g),已知:平均反应速率vC=
pC(g)+qD(g),已知:平均反应速率vC= vA;反应2 min时,A的物质的量减少了
vA;反应2 min时,A的物质的量减少了 ,B的物质的量减少了
,B的物质的量减少了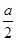 mol,有a mol D生成。回答下列问题:
mol,有a mol D生成。回答下列问题:
(1)反应2 min内,vA=_____mol/(L·min);
(2)化学方程式中,x:y:p:q= ;
(3)反应平衡时,D为2a mol,则B的转化率为________;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1.5 a mol,则该反应的ΔH________0;(填“>”“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率_____,(填“增大”、“减小”或“不变”)理由是 ;
②平衡时反应物的转化率________,(填“增大”、“减小”或“不变”)
理由是 。
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是 。
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将 (填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500 s内N2O5的分解速率为 。
③在T2温度下,反应1000 s时测得NO2的浓度为4.98 mol·L-1,则T2 T1(填>、<或=)。
(3)现以H2、O2、熔融Na2CO3组成的燃料电池采用电解法制备N2O5,装置如图所示,其中Y为CO2。
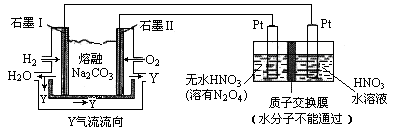
写出石墨Ⅰ电极上发生反应的电极反应式 ,
N2O5在电解池的 区生成(填“阳极”或“阴极”)。
碳的氧化物在工业上有着广泛的应用,如CO 和H2可以合成甲醇,CO2和NH3可以合成尿素。(共计12分)
Ⅰ.若在20L的密闭容器中按物质的量之比1︰2充入CO和H2,发生反应:
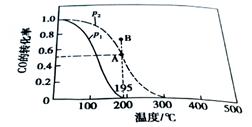
CO(g)+ 2H2(g) CH3OH(g)。测得平衡时CO得转化率随温度变化及压强的变化如图所示:p2、195℃时,n(H2)随时间的变化如表所示:
CH3OH(g)。测得平衡时CO得转化率随温度变化及压强的变化如图所示:p2、195℃时,n(H2)随时间的变化如表所示:
| t/min |
0 |
1 |
3 |
5 |
| n(H2)/mol |
8 |
5 |
4 |
4 |
(1)p2、195℃时,0~1min内,υ(H2)= mol/(L·min)。
(2)你认为p1 p2; p2、195℃时,B点,υ(正) υ(逆)。(填“﹤”“﹥”或“=”)
(3)p2、195℃时,该反应的化学平衡常数为 ;
Ⅱ.NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下:
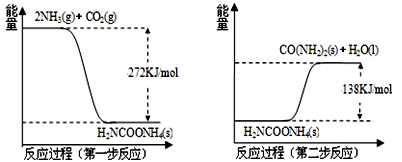
(1)NH3(g)与CO2(g)反应生成尿素的热化学方程式为 。
(2)工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有 (填序号)
A.升高温度 B.加入催化剂
C.将尿素及时分离出去 D.增大反应体系的压强
向某密闭容器中加入0.15 mol/L A、0.05 mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0时c(B)未画出,t1时增大到0.05 mol/L]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
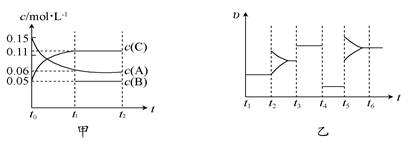
(1)若t1=15s,则t0~t1阶段v(C)=______ _,A的转化率为______ __。
(2)若t5时改变的条件是升温,此时v(正)>v(逆),若A的物质的量减少0.03 mol时,容器与外界的热交换总量为akJ,写出该反应的热化学方程式 。
(3)若t4时改变的条件为减小压强,则B的起始物质的量浓度为____ _mol/L。
(4)t3时改变的某一反应条件可能是_______ _(选填序号)。
a.使用催化剂 b.增大压强 c.增大反应物浓度
硫及其化合物在工业生产中有重要的应用,它们性质的研究对工业生产有重要的指导意义。
(1)2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。
2SO3(g),反应过程的能量变化如图所示。
已知1 mol SO2(g)氧化为1 mol SO3(g)放出的热量为99 kJ。请回答下列问题:
①图中E表示_________,E的大小对该反应的反应热有无影响?___________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________,理由是_____________;
②图中ΔH=________kJ·mol-1;
(2)下图表示在密闭容器中反应2SO2+O2 2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。

①a b过程中改变的条件可能是 ;
②b c过程中改变的条件可能是 ;
③若增大压强时,反应速率变化情况画在c~d处。
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为: ;
(2)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为__ ;
(3)COCl2的分解反应为COCl2(g)= Cl2(g)+ CO(g) △H =" +108" kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):

①计算反应在第8 min时的平衡常数K = __________(保留小数点后三位)
②比较第2 min反应温度T(2)与第8 min反应温度(T8)的高低:T(2)____T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= ______mol/L;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v (2—3)、v(5—6)、v (l2-13)表示]的大小___________;
⑤比较反应物COCl2在5-6 min和15-16 min时平均反应速率的大小:v (5-6) v(15-16)(填“<”、“>”或“=”),原因是____________。
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O (l)△H1=﹣2741.8kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=﹣566kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) 的△H= 。
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g) CO2(g)+H2(g)△H=+41.2kJ/mol
CO2(g)+H2(g)△H=+41.2kJ/mol
①下列事实能说明该反应达到平衡的是 。
a.体系中的压强不发生变化
b.V正(H2)="V" 逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO2的浓度不再发生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2O)= ;此时该反应的平衡常数K为 。
③向平衡体系中充入少量CO则平衡常数K (填“增大”、“减小”或“不变”)
依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2﹣,电池内部O2﹣由 极移向 极(填“正”或“负”);电池的负极电极反应式为 。
(3)用上述燃料电池和惰性电极电解足量Mg(NO3)2和NaCl的混合溶液.电解开始后阴极区的现象为 。
(15分)开发、使用清洁能源发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:
①2CH3OH(l)+3O2(g)= 2CO2(g)+4H2O(g)ΔH1=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)ΔH2=-566.0 kJ·mol-1
③H2O(g)=H2O(l)ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)生产甲醇的原料CO和H2来源于: CH4(g)+H2O(g) CO(g)+3H2(g)ΔH>0
CO(g)+3H2(g)ΔH>0
①该反应的平衡常数表达式K= ,一定条件下CH4的平衡转化率与温度、压强的关系如图a。则T1 T2(填“<”“>”或“=”下同),A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。
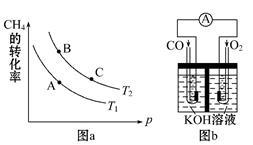
②120℃时,将1 mol CH4和2 mol H2O(g)通入容积为1 L的密闭容器中发生反应,不能说明该反应已经达到平衡状态的是 。
a.容器内气体密度恒定
b.混合气体的相对分子质量恒定
c.容器内的压强恒定
d.3v正(CH4)=v逆(H2)
e.单位时间内消耗0.3 mol CH4同时生成0.9mol H2
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。当有4mol电子通过导线时,消耗标准状况下的O2体积为 L ,此时电解质溶液的PH值 (填“变大”、“变小”或“不变”)
对碳及其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响。
(1)25℃时,石墨和CO的燃烧热分别为:393.5kJ/mol、283.0kJ/mol。请写出石墨不完全燃烧时的热化学方程式 。
(2)25℃时,反应2CO2(g) 2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。
2CO(g)+ O2(g)的平衡常数K=2.96×10-92。在一个体积可变的密闭容器中(起始时容器体积为1L)充入一定量CO2、CO、O2的混合气体,要使容器中的反应开始时向CO2分解的方向进行,起始时三种气体的物质的量浓度应满足的关系是 。当该反应在25℃时达到平衡后,其他条件不变时,升高温度或增加容器的压强,均能使该平衡发生移动,②请在坐标中作出该反应的平衡常数K随温度(T)、压强(p)变化的示意图。

(3)1600℃时,反应2CO(g)+ O2(g) 2CO2(g)的平衡常数K=1.0×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1600℃时的补燃器,并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则经补燃处理后尾气中CO的浓度为 mol/L(结果保留两位有效数字)。
2CO2(g)的平衡常数K=1.0×108。经测定,汽车尾气中CO和CO2气体的浓度分别为4.0×10-5mol/L和4.0×10-4mol/L。若在汽车的排气管上增加一个1600℃时的补燃器,并不断补充O2使其浓度始终保持为4.0×10-4mol/L。则经补燃处理后尾气中CO的浓度为 mol/L(结果保留两位有效数字)。
(4)以CO和O2为电极燃料,以熔融K2CO3为电解质组成燃料电池,请写出该电池的负极反应式 。
节能减排已经成为全社会的共识,浙江省在原先推行乙醇汽油的基础上,开始试点甲醇汽油(即在汽油中添加一定量的甲醇),根据检测的数据分析认为,若宁波全市的140余万辆机动车全部使用甲醇汽油,一年内能减少有害气体(一氧化碳)排放将近100万吨。甲醇常利用煤气化过程中生成的CO和H2来制备:CO+2H2 CH3OH。请根据图示回答下列:
CH3OH。请根据图示回答下列:

(1)关于该反应的下列说法中,正确的是 (填字母):
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,净测得CO和CH3OH(g)的浓度随时间变化如(图1)所示。从反应开始到平衡,CO的平均反应速率v(CO)= ,该反应的平衡常数K= 。
(3)恒容条件下,达到平衡后,下列措施中能使n(CH3OH)/n(CO)增大的有 。
A.升高温度 B.充入He气
C.再充入1molCO和3molH2 D.使用催化剂
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH3OH,达到平衡时测的混合气体的密度是同温同压下起始的1.6倍(此过程三种物质均处于气态),则平衡时混合气体的平均摩尔质量=_____g/mol。
(5)根据(图2),写出此反应的热化学方程式 。
(9 分)碳元素是形成物种最多的元素之一,其中许多物质对人类来说有着极其重要的作用。
(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,它是世界上最薄却也是最坚硬的纳米材料,同时也是导电性最好的材料。下列物质在一定条件下能与它反应的是________(填字母)。
| A.氧气 | B.单质氟 | C.氢氧化钠溶液 | D.浓硝酸 |
(2)①CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206 kJ·mol-1
②CO(g)+2H2(g)="==" CH3OH(g) ΔH=-91kJ·mol-1
则CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_____________。
(3)工业中用乙苯为原料,采用催化脱氢的方法制取苯乙烯的反应方程式为:
C6H5-CH2CH3(g) C6H5-CH=CH2(g)+H2(g)△H1
C6H5-CH=CH2(g)+H2(g)△H1
向体积为VL 的密闭容器中充入a mol 乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示,在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:


①计算600℃温度下该反应的平衡常数 。
②分析上述平衡体系组成与温度的关系图可知:△H1 0(填“>、=或<” )。
(4)某科研组设计如图装置,模拟“人工树叶”电化学实验装置如右图所示,该装置能将H2O 和CO2转化为O2和燃料(C3H8O)。该装置工作时,a 电极的反应为 。
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH约为 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
2H2(g)+O2(g)=2H2O(g) K1
2C(s)+O2(g)=2CO(g) K2
C(s)+ H2O(g)=CO(g)+ H2(g) K=_______(用含K1、K2的式子表示)。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
A.Ca(OH)2 B.Na2CO3 C.CaCl2 D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化为
①已知气缸中生成NO的反应为:N2 (g)+O2(g) 2NO(g) △H
2NO(g) △H 0
0
若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g)。已知该反应的△H 0,简述该设想能否实现的依据 。
0,简述该设想能否实现的依据 。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
(1)已知常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ/mol
②H2O(l)=H2O(g) △H=+44.0kJ/mol
写出甲醇燃烧的热化学方程式_____________________。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。工业上用如下方法好处甲醇:

①方法一:该反应的△S_____0(填“>”或“<”)。图中曲线a到曲线b的措施是_________,恒温恒容时,下列说法能说明反应到达平衡状态的是________。
| A.体系的平均摩尔质量不再改变 | B.V(CO)=V(CH3OH) |
| C.H2的转化率达到了最大限度 | D.△H不再改变 |
②方法二:将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系,其中a点的平衡常数表达式为:___________;a,b两点化学反应速率别用Va、Vb表示,则Va_____Vb(填“大于”、“小于”或“等于”)。已知原子利用率=期望产物的总质量与生成物的总质量之比,则方法二的原子利用率与方法一的原子利用率之比为___。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。写出除去甲醇的离子方程式_________。
(实验班做)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,CO2(g)+3H2(g)  CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=_________________。500℃达平衡时,CH3OH(g)的体积分数为 ,图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为 反应(填“放热”或“吸热”)。
(2)500℃该反应的平衡常数为 (保留两位小数),若提高温度到800℃进行,达平衡时,K值 (填“增大”“减小”或“不变”)。
(3)下列措施中不能使CO2的转化率增大的是________________。
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂
E.将水蒸气从体系中分离出
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0. 5mol/L,则此时v(正) v(逆)(填“>”“<”或“=”)。
(5)下列措施能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2+3H2  CH3OH+H2O,该反应的能量变化如图所示:
CH3OH+H2O,该反应的能量变化如图所示:
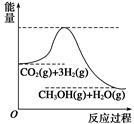
(1)甲同学认为该反应为放热反应,他的理由为: 。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5min末,用CO2浓度变化表示的平均反应速率v(CO2)= ;反应达到平衡状态,此时H2的转化率为 。
| t/min |
0 |
2 |
5 |
10 |
15 |
| n(CO2)/mol |
1 |
0.75 |
0.5 |
0.25 |
0.25 |
(3)在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是 (填序号)。
a.v生成(CH3OH)=v消耗(CO2)
b.CO2、H2、CH3OH、H2O的浓度均不再变化
c.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
d.H2的消耗速率与CH3OH的消耗速率之比为3∶1
试题篮
()