二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。

(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如右图所示。
根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,
体系总压强为0.10MPa。该反应的平衡常数等于_______。
②若改在容器中加入1.0 mol SO2、0.5mol O2和amol SO3,保持温度不变反应达平衡后,体系总压强也为0.10MPa,则a=_________mol。SO2的平衡转化率为_________________。[
③平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+C02(g)+2H20(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H20(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2整个过程中,放出的热量为______kJ。
化学反应A(g)+B(g) C(g)+D(g)ΔH<0,850℃时,K="l" t℃时,在一定体积的容器中,通入一定量的A和B,发生反应,各物质浓度随时间变化如下表:
C(g)+D(g)ΔH<0,850℃时,K="l" t℃时,在一定体积的容器中,通入一定量的A和B,发生反应,各物质浓度随时间变化如下表:
t℃时物质的浓度(mol·L-1)变化
| 时间/min |
A |
B |
C |
D |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
0.100 |
0.200 |
0.100 |
0.100[科网] |
| 4 |
0.100 |
0.200 |
0.100 |
0.100 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
|
(1)计算t℃该化学反应的平衡常数: 。
(2)t℃ 850℃(填大于、小于或等于)。判断依据是 。
(3)反应在4min~5min之间,平衡 (填“向左”、“向右”或“不”)移动,可能的原因是 。
a.增加A的浓度 b.增加D的浓度 c.增加C的浓度 d.使用催化剂
(4)某温度下反应C(g)+D(g)  A(g)+B(g)的平衡浓度符合c(C)·c(D)=2c(A)·c(B),则此时的温度 850℃(填大于、小于或等于):
A(g)+B(g)的平衡浓度符合c(C)·c(D)=2c(A)·c(B),则此时的温度 850℃(填大于、小于或等于):
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。
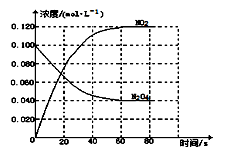
在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1,
平衡时混合气体中NO2的体积分数为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),
②列式计算温度T时反应的平衡常数K 。
(3)温度T时反应达平衡后,向容器中,迅速充入含0.08mol的NO2和0.08mol N2O4的混合气体,此时速率关系v(正) v(逆)。(填“大于”,“等于”,或“小于”)
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g);ΔH1=+489.0 kJ·mol-1
C(s)+CO2(g)=2CO(g);ΔH2=+172.5 kJ·mol-1。
则CO还原Fe2O3的热化学方程式为______________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CH3OH的物质的量随时间的变化如图所示,请回答下列问题:
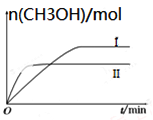
①该反应的平衡常数的表达式为K=___ ____。
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ _KⅡ(填“大于” 、“等于”或“小于”)。
③在下图a、b、c三点中,H2的转化率由高到低的顺序是__________(填字母)。
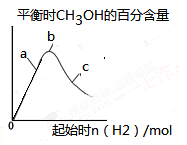
(3)在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是 。
a.氢气的浓度减小
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
(4)在恒温恒容条件下,起始加入的反应物不变,要增大CH3OH 的产率,可以采取的有效措施是
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____________
(2)该反应为_____________反应(选填“吸热”“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_____________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2) = c(CO)
(4)某温度下,平衡浓度符合c(CO2)·c(H2)= c(CO)﹒ c(H2O),试判断此时的温度为 ℃。
1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟哈伯合成氨的工业化生产:N2(g)+3H2(g) 2NH3(g)△H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如下图所示。
2NH3(g)△H<0。当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如下图所示。

回答下列问题:
(1)已知: ,
, ,则反应N2(g)+3H2(g)
,则反应N2(g)+3H2(g) 2NH3(g)的△H= (用含△H1、△H2的代数式表示)。
2NH3(g)的△H= (用含△H1、△H2的代数式表示)。
(2)合成氢的平衡常数表达式为____ ,平衡时,M点NH3的体积分数为10%,则N2的转化率为____ (保留两位有效数字)。
(3)X轴上a点的数值比b点 (填“大”或“小”)。上图中,Y轴表示 (填“温度”或“压强”),判断的理由是 。
(4)若将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件和平衡时的相关数据如下表所示:

下列判断正确的是_____________。
| A.放出热量:Ql< Q2< △Hl | B.N2的转化率:I> III |
| C.平衡常数:II >I | D.达平衡时氨气的体积分数:I>II |
(5)常温下,向VmL amoI.L-l的稀硫酸溶液中滴加等体积bmol.L-l的氨水,恰好使混合溶液呈中性,此时溶液中c(NH4+)______________c(SO42-)(填“>”、“<”或“=”)。
(6)利用氨气设计一种环保燃料电池,一极通入空气,另一极通入氧气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。写出负极的电极反应式_ _________。
氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得。实验研究认为,该碳热还原反应分两步进行:①Al2O3在碳的还原作用下生成铝的气态低价氧化物X(X中Al与O的质量比为6.75∶2);②在碳存在下,X与N2反应生成AlN。请回答:
(1)X的化学式为 。
(2)碳热还原制备氮化铝的总反应化学方程式为:
Al2O3(s)+3C(s)+N2(g) 2AlN(s)+3CO(g)
2AlN(s)+3CO(g)
①在温度、容积恒定的反应体系中,CO浓度随时间的变化关系如下图曲线甲所示。下列说法不正确的是 。

A.从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率
B.c点切线的斜率表示该化学反应在t时刻的瞬时速率
C.在不同时刻都存在关系:v(N2)=3v(CO)
D.维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙
②一定温度下,在压强为p的反应体系中,平衡时N2的转化率为α,CO的物质的量
浓度为c;若温度不变,反应体系的压强减小为0.5p,则N2的平衡转化率将 α (填“<”、“=”或“>”),平衡时CO的物质的量浓度
A.小于0.5c B.大于0.5c,小于c
C.等于c D.大于c
③该反应只有在高温下才能自发进行,则随着温度升高,反应物Al2O3的平衡转化率将 (填“增大”、 “不变”或“减小”),理由是 。
(3)在氮化铝中加入氢氧化钠溶液,加热,吸收产生的氨气,进一步通过酸碱滴定法可以测定氮化铝产品中氮的含量。写出上述过程中氮化铝与氢氧化钠溶液反应的化学方程式 。
烟气脱硫(SO2)脱硝(NOx)一体化技术是大气污染防治研究的热点。烟气中NO通常占NOx总量的90%以上,但NO的脱除难度较大。某研究小组探究用次氯酸钙溶液同时脱除烟气中SO2和NO的方法。
脱硫:Ca(ClO)2(aq) + 2SO2(g) + 2H2O(l)=CaSO4(s) + H2SO4(aq) + 2HCl(aq) Ⅰ
脱硝:3Ca(ClO)2(aq) + 4NO(g) + 2H2O(l)=3CaCl2(aq) + 4HNO3(aq) Ⅱ
请回答:
(1)脱硫过程涉及的各化学反应及其ΔH如下:
SO2(g) + H2O(l)  H2SO3(aq) ΔH=a
H2SO3(aq) ΔH=a
Ca(ClO)2(aq) + H2SO3(aq) = CaSO3(s) + 2HClO(aq) ΔH=b
CaSO3(s) + HClO(aq) = CaSO4(s) + HCl(aq) ΔH=c
H2SO3(aq) + HClO(aq) = H2SO4(aq) + HCl(aq) ΔH=d
脱硫反应Ⅰ的ΔH1= 。
(2)脱硫反应Ⅰ和脱硝反应Ⅱ的平衡常数随温度的变化如下图所示:
①判断反应Ⅱ的ΔS2 0、ΔH2 0(填<、=或>),指出有利于自发进行的温度条件是 (填“较高温度”或“较低温度”)。
②预测用次氯酸钙溶液脱硫脱硝反应进行的程度并说明理由 。
(3)与NaClO溶液吸收法相比,Ca(ClO)2法更能促进脱硫反应进行,理由是 。
(4)与NaOH溶液吸收法相比,Ca(ClO)2法的脱硫脱硝效率更高,理由是 。
T1温度下,体积为 2L的恒容密闭容器,加入4.00molX,2.00molY,发生化学反应 2X(g)+Y(g) 3M(g)+N(s) △H<0。
3M(g)+N(s) △H<0。
部分实验数据如表格所示。

(1)前500s反应速率v(M)=_____,该反应的平衡常数K=_____。
(2)若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____(填序号)
a.X的消耗速率与M的消耗速率相等 b.混合气体的平均相对分子质量不变
c.v(Y)与v(M)的比值不变 d.固体的总质量不变
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些_____。

a.Y的逆反应速率
b.M的体积分数
c.混合气体的平均相对分子质量
d.X的质量分数
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____。
| A.平衡不移动 |
| B.重新达平衡后,M的体积分数小于50% |
| C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍 |
| D.重新达平衡后,Y的平均反应速率与原平衡不相等 |
E.重新达平衡后,用X表示的v(正)比原平衡大
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度_____1.5mol/L(填“>”、“=”或“<”),理由是_____。
在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,如下反应:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K2=________,反应
CO2(g)+H2(g)的平衡常数K2=________,反应  CO2(g)+
CO2(g)+ H2(g)
H2(g)
 CO(g)+
CO(g)+ H2O(g)的平衡常数K3=________。
H2O(g)的平衡常数K3=________。
(3)已知在1 000 ℃时,该反应的平衡常数K4为1.0,则该反应为________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是______。(填编号)
| A.容器中压强不变 |
| B.c(CO2)=c(CO) |
| C.生成a mol CO2的同时消耗a mol H2 |
| D.混合气体的平均相对分子质量不变 |
(5)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v正________v逆(填“>”、“=”或“<”)。该温度下反应达到平衡时,CO2的转化率为________。
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)  2NO2(g) △H,随温度升高,混合气体的颜色变深。
2NO2(g) △H,随温度升高,混合气体的颜色变深。

回答下列问题:
(1)反应的△H__________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,平均反应速率v(NO2)为__________mol·L-1·s-1,反应的平衡常数K为_____________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4) 以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T___________100℃(填“>”或“<”)。
(3)100℃时达到平衡后, 继续往容器中通入0.1N2O4 mol,则化学平衡_________(填“左移”、“右移”或“不移动”),达到新平衡时N2O4 的浓度________0.04mol/L。
氮元素能形成多种多样的化合物。
(1)己知N2O4 (g)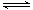 2NO2 (g) ΔH=+57.20 kJ/mol ,t℃时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2 (g) ΔH=+57.20 kJ/mol ,t℃时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
| c(X)/(mol/L) |
0.2 |
c |
0.6 |
0.6 |
1.0 |
c1 |
c1 |
| c(Y)/(mol/L) |
0.6 |
c |
0.4 |
0.4 |
0.4 |
c2 |
c2 |
①c(X)代表 (填化学式)的浓度,该反应的平衡常数K= 。
②20 min时改变的条件是 ;重新达到平衡时,N2O4的转化率将 (填选项前字母)。
a.增大 b.减小 c.不变 d.无法判断
③t℃时,下列情况不能说明该反应处于平衡状态的是 ;
A.混合气体的密度保持不变 B.混合气体的颜色不再变化
C.混合气体的气体压强保持不变 D.N2O4与NO2的物质的量比为10:3
④若反应在t℃进行,某时刻测得n(NO2)="0.6" mol、n(N2O4)=1.2mol,则此时v(正) v(逆)(填 “>” 、“<”或“=”)。
(2)已知2N2H4(l)+N2O4(l)="3N2(g)+4H2O(l)" ΔH=" -1225" kJ/mol
| 化学键 |
N-H |
N-N |
N≡N |
O-H |
| 键能(kJ/mol) |
390 |
190 |
946 |
460 |
则使1 mol N2O4 (l)完全分解成相应的原子时需要吸收的能量是 。
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题。
I.对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。2xCO+2NOx==2xCO2+N2,当转移电子物质的量为0.8xmol时,该反应生成 LN2(标准状况下)。
II.一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,可以用来合成很多有机物如甲醇(CH3OH)、二甲醚(CH3OCH3)等,还可以作燃料。
(1)在压强为0.1 MPa条件下,将amol CO与3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g) △H<0
CH3OH(g) △H<0
①该反应的平衡常数表达式为 。
②若容器容积不变,下列措施可增加甲醇产率的是 。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1 mol CO和3 mol H2 |
(2)已知:①CO(g)+2H2(g)CH3OH(g) △H=-90.7 kJ·mol-1
②2CH3OH(g)CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
③CO(g)+H2O(g)CO2(g)+H2(g) △H=-41.2 kJ·mol-1
则3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)的△H=
(3)CO—空气燃料电池中使用的电解质是掺杂Y2O3的ZrO2晶体,它在高温下能传导O2—,该电池负极的电极反应式为 。
(4)甲醇也是新能源电池的燃料,但它对水质会造成一定的污染。有一种电化学法可消除这种污染。其原理是: 2滴甲醇,1mL 1.0mol·L—1硫酸,4mL 0.1mol·L—1硫酸钴
(CoSO4)混合溶液,插上两根惰性电极,通电后,将Co2+氧化成Co3+,
然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用图装置模拟上述过程:

①检验电解时产生的CO2气体,井穴板穴孔内应盛放 溶液。
②写出净化甲醇的离子方程式 。
I.X、Y是相邻周期、相邻主族的短周期元素,且原子序数X>Y.填写下列空白:
(1)若X为金属元素,Y为非金属元素,Y2H4是一种重要有机化工原料。
①X单质与Fe2O3反应时,每消耗13.5g X放热213kJ,该反应的热化学方程式是 ;
②写出实验室制备Y2H4的化学方程式 ;
(2)若X、Y元素的最高价氧化物的水化物都是强酸。
为防止YO2污染空气,科学家寻求合适的化合物G和催化剂,以实现反应:
YO2+G Y2+H2O+n Z(未配平,n可以为0)
Y2+H2O+n Z(未配平,n可以为0)
①上述反应式中的G不可能是 (填标号)。
A.NH3 B.CO C.CH3CH2OH
②25℃时,往a mol•L﹣1的YH3的水溶液(甲)中滴加0.01mol•L﹣1H2XO4溶液(乙),当甲与乙等体积混合时,溶液呈中性(设温度不变),甲中溶质的电离常数Kb= (用含a的代数式表示)。
Ⅱ.离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7﹣和AlCl4﹣组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
Ⅲ.甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.工业上可用CO和H2制取甲醇,化学方程式为:CO(g)+2H2(g)═CH3OH(g) △H="b" kJ/mol,为研究平衡时CO的转化率与反应物投料比( )及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并绘出如图所示:
)及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并绘出如图所示:

(1)反应热b 0 (填“>”或“<”)。
(2)若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,A点的平衡常数KA= ,B点的平衡常数KB KA(填“>”或“<”或“=”)。
(3)为提高CO转化率可采取的措施是 、 (答出两条即可)。
附加题
Ⅰ:如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和
1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g) 2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:

(1)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是 。
(2)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,反应化学平衡常数为____。
(3)若达到平衡时,隔板K最终停留在左侧刻度靠近0处, 则乙中可移动活塞F最终停留在右侧的刻度不大于 ;
Ⅱ:若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)测得甲中A的转化率为b,则乙中C的转化率为 ;
(2)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。
试题篮
()