运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义(1)硫酸生产中,SO2催化氧化生成SO3; 2SO2(g)+O2(g) 2SO3(g),平衡时,混合体系中SO3的百分含量和温度的关系如下图所示。根据图示回答下列问题:
2SO3(g),平衡时,混合体系中SO3的百分含量和温度的关系如下图所示。根据图示回答下列问题:

①2SO2(g)+O2(g) 2SO3(g)的△H 0(填 “>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”)
2SO3(g)的△H 0(填 “>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”)
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1 K2;温度为T1时,反应进行到状态D时,
 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
①如图是一定的温度和压强下N2(g)和H2(g)反应生成lmol NH3(g)过程中能量变化示意图,图中E1、E2分别表示的意义是____________、____________
②请写出工业合成氨的热化学方程式: (△H的数值用含字母Q1、Q2的代数式表示)
(14分)请回答下列问题:
(1)下表列出了一些化学键的键能E:
| 化学键 |
H—H |
O===O |
O—H |
| E/kJ·mol-1 |
436 |
x |
463 |
反应H2(g)+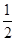 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1,则x=__________。
(2)铅蓄电池是正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质溶液是H2SO4溶液,电池放电时的总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
请写出充电时阴极的电极反应式:__________________
(3)反应m A+n B p C,在某温度下达到平衡。
p C,在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是________________。
②若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向________________方向移动。
③若再升高温度,平衡向逆向移动,则正反应为 _________ 反应(填“吸热”或“放热”)
(4)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如图所示。

①请在图中标出电极材料及电解质溶液(写化学式)________________
②盐桥中的Cl-向________极移动(填“左”或“右”)。
CH4既是一种重要的能源,也是一种重要的化工原料。
(1)已知8.0 g CH4完全燃烧生成液体水放出444.8kJ热量。则
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= kJ·mol-1。
(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,则通入a气体的电极名称为 ,通入b气体的电极反应式为 。(质子交换膜只允许H+通过)
(3)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在 左右。
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为 。
(4)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96 L CH4可处理22.4 L NOx,则x值为 。
汽车尾气和燃煤尾气是造成空气污染的原因之一。

(1)汽车尾气净化的主要原理为2N0+2C0→ 2C02+N2。在密闭容器中发生该反应时,c(C02)随温度(T)和时间(t)的变化曲线如图所示。
①T1 (填“>”“<”或“=”)T2
②在T2温度下,0〜2 S内的平均反应速率 (N2)=。
(N2)=。
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 。

(2)NH3催化还原氮氧化物(SCR)技术是目前应用广泛的烟气氮氧化物脱除技术。用Fe作催化剂时,在氨气足量的情况下,不同  对应的脱氮率如图所示。
对应的脱氮率如图所示。

脱氮效果最佳的= 。此时对应的脱氮反应的化学方程式为 。
(3)NO2、O2和熔融NaNO3可形成燃料电池,其原理如图所示。该电池在使用过程中石墨I电极上生成N2O5,其电极反应式为 。

(1)联氨(N2H4)是一种高能燃料。工业上可以利用氮气和氢气制备联氨。
已知:N2(g)+2H2(g)=N2H4(l) △H=" +" 50.6kJ·mol-1; 2H2(g)+O2(g)=2H2O(l) △H="-571.6" kJ·mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l) △H= kJ·mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 。
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 。
(2)在纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,则N2H4发生分解反应的化学方程式为 。
(3)N2H4与亚硝酸反应可生成氮的另一种氢化物,在标准状况下,该氢化物气体的相对分子质量为43.0,其中氮原子的质量分数为0.977。该氢化物受撞击后可完全分解为两种单质气体。该氢化物分解的化学方程式为 。
(4)氨氧化法制硝酸工业尾气中的NO、NO2气体可用氨水吸收,反应方程式为6NO+4NH3===5N2十6H2O,6NO2+8NH3===7N2+12H2O。若尾气中NO和NO2共18 mol被氨水完全吸收后,产生了15.6 mol N2,则此尾气中NO与NO2的体积比为 。
碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g) WI2(g)。为模拟上述反应,在实验室中准确称取0.508 g碘、0.736 g金属钨放置于50.0 mL密闭容器中,并加热使其反应。下图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)-t],其中曲线I(0 ~t2:时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
WI2(g)。为模拟上述反应,在实验室中准确称取0.508 g碘、0.736 g金属钨放置于50.0 mL密闭容器中,并加热使其反应。下图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)-t],其中曲线I(0 ~t2:时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
请回答下列问题:
(1)该反应是______________(填“放热”或“吸热”)反应。
(2)反应从开始到t1(t1 =3min)时间内的平均速率v(I2)=____________
(3)在450℃时,该反应的平衡常数K=_________________。
(4)能够说明上述反应已经达到平衡状态的有____________。
| A.I2与WI2的浓度相等 |
| B.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等 |
| C.容器内混合气体的密度不再增加 |
| D.容器内气体压强不变化 |
(5)假设灯丝温度为660℃,灯泡壁温度为350℃。请根据化学反应原理分析在灯泡内充入碘能够延长钨丝寿命的原因____________________________。
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与N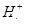 具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强。
具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强。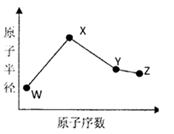
(1)Y在周期表中的位置是 。
(2)用电子式表示化合物X3W的结构 。
(3)X3W遇水可释放出使酚酞溶液变红的气体A,该反应的化学方程式是 。
(4)同温同压下,将a L W的简单氢化物和b LZ的氢化物通入水中,若所得溶液的pH=7则a b(填“>”或“<”或“=”)。
(5)用惰性电极电解化合物XZ溶液从阴极释放出气休B,该反应的离子方程式是 。
(6)已知W的单质与气体B在一定条件下可形成气体A,即: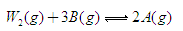 △H=—92.4kJ·mo1-1
△H=—92.4kJ·mo1-1
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
| 时间 |
浓度(mo1/L) |
||
| c(W2) |
c(B) |
c(A) |
|
| 第0 min |
4.0 |
9.0 |
0 |
| 第10 min |
3.8 |
8.4 |
0.4 |
| 第20 min |
3.4 |
7.2 |
1.2 |
| 第30 min |
3.4 |
7.2 |
1.2 |
| 第40 min |
3.6 |
7.8 |
0.8 |
①0min~10min,W2的平均反应速率 。
②反应在第l0min改变了反应条件,改变的条件可能是 。
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是 。
a.更新了催化剂 b.升高温度 c.增大压强 d.减小A的浓度
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知拆开1 mol H2、1 mol O2和液态水中1 mol O—H键使之成为气态原子所需的能量分别为436 kJ、496 kJ和462 kJ;CH3OH(g)的燃烧热为627 kJ·mol-1。
则CO2(g)+3H2(g)=CH3OH(g)+H2O(l) ∆H= kJ·mol-1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①该反应平衡常数表达式K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的∆H 0,(填“>”或“<”)。若温度不变,减小反应投料比[n(H2)/n(CO2)],则K将 (填“增大”、“减小”或“不变”)。
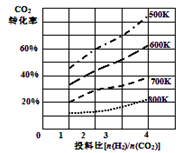
③某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,当下列物理量不再发生变化时,能表明上述可逆反应达到化学平衡的是 。
| A.二氧化碳的浓度 | B.容器中的压强 |
| C.气体的密度 | D.CH3OCH3与H2O的物质的量之比 |
(3)向澄清的石灰水中通入CO2至溶液中的Ca2+刚好完全沉淀时,则溶液中c(CO32 -)= 。[已知:Ksp(CaCO3)=2.8×10-9]
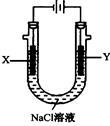
(4)以甲醚、空气、氢氧化钾溶液为原料的燃料电池为电源,以石墨为电极电解500 mL滴有酚酞的NaCl溶液,装置如图所示:请写出电解过程中Y 电极附近观察到的现象 ;当燃料电池消耗2.8L O2(标准状况下)时,计算此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。
(1)已知某可逆反应mA(g)+nB(g)  qC(g)在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空:
qC(g)在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空:

①化学计量数的关系:m+n_________q;(填“>”.“<”或“=”)
②该反应的正反应为___________反应。(填“吸热”或“放热”)
③升高温度正反应速率 逆反应速率 (填“加快”或者“减慢”)但v正 v逆(填“>”.“<”或“=”)
(2)在FeCl3+3KSCN Fe(SCN)3+3KCl的平衡体系中,回答下列问题:(填“正向”、“逆向”、“不”)
Fe(SCN)3+3KCl的平衡体系中,回答下列问题:(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡 __________移动。
②在溶液中加入少量的KCl固体,平衡 _________移动。
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛.生产煤炭气的反应之一是:C(s)+H2O(g) CO(g)+H2(g) H=+131.4kJ/mol
CO(g)+H2(g) H=+131.4kJ/mol
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5min的平均反应速率为______________。
(2)关于上述反应在化学平衡状态时的描述正确的是___________.
A.CO的含量保持不变
B.v正(H2O)=v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在图中继续画出t1时刻之后正反应速率随时间的变化:
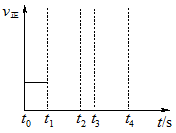
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示).
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热分别为725.8kJ/mol,283.0kJ/mol,1molH2O(l)变为H2O(g)吸收44.0 kJ的热量,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式_______________________
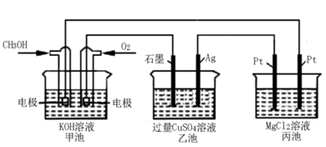
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程.乙池中发生反应的离子方程式为_____________。当甲池中增重16g时,丙池中理论上产生沉淀质量的最大值为_________g。
化学反应原理在生产和科研中有重要的应用,请利用相关知识回答下列问题。
I.常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s)  5CO2(g)+I2(s) △H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO。反应中CO2的体积分数φ(CO2)随时间的变化如图所示:
5CO2(g)+I2(s) △H<0.一定温度下,向2L恒容密闭容器中加入足量I2O5(s),并通入1molCO。反应中CO2的体积分数φ(CO2)随时间的变化如图所示:

(1)该反应的平衡常数表达式K=__________;
(2)0~0.5min内的平均反应速率v(CO)=_________;
(3)下列叙述能说明反应达到平衡的是( )
A.容器内压强不再变化
B.CO的质量不再变化,CO2的转化率不再增大
C.CO2的生成速率等于CO的消耗速率,反应物不再转化为生成物
D.混合气体的平均相对分子质量不再改变
(4)保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是( )
A.平衡时生成I2的质量为原来的2倍
B.达到平衡的时间为原来的2倍
C.平衡时混合气体的物质的量为原来的2 倍
D.平衡时混合气体的密度不变
II.一定条件下在密闭容器中加入NH4I发生反应:A.NH4I(s) NH3(g)+HI(g),
NH3(g)+HI(g),
B.2HI(g)  H2(g)+I2(g)。达到平衡后,扩大容器体积,反应b 的移动方向___________(填正向、逆向或不移动);
H2(g)+I2(g)。达到平衡后,扩大容器体积,反应b 的移动方向___________(填正向、逆向或不移动);
III.己知:2NO2 N2O4 △H<0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
N2O4 △H<0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )

A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.若反应在一绝热容器中进行,则b、c两点的平衡常数Kb>Kc
D.d点:v(正)>v(逆)
(1)现有可逆反应.2NO2(g) N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时采取的措施。
N2O4(g),△H<0,试根据下列图象判断t2、t3、t4时采取的措施。
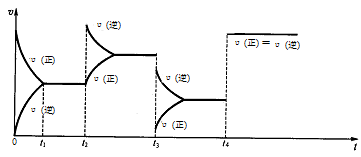
t2: ;
t3: ;t4: 。
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) C(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| C(N2O4) |
0.20 |
a |
0.10 |
c |
d[] |
e |
| C(NO2) |
0.00 |
0.12 |
b |
0.22 |
0.22 |
0.22 |
(2)40s时,NO2的产率是 。
(3)20s时,N2O4的浓度为 mol/L,0~20s内N2O4的平均反应速率为 。
(4)在80℃时该反应的平衡常数K值为 (保留2位小数)。
(5)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大
(6)利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为:__ 。
I.(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率VA VC(同上)。
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率VA VC(同上)。

(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,
每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
①该反应的平衡常数K的值为 ;
②若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol/L。
③计算②中条件下达到平衡后混合气体的平均相对分子质量为 ;(结果保留小数点后一位)
II. 在0.5 L的密闭容器中,一定量的H2和N2进行如下化学反应:3H2(g)+N2(g) 2NH3(g) △H <0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。
2NH3(g) △H <0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。
| t/℃ |
200 |
300 |
400 |
| K |
K1 |
K2 |
0.5 |
④比较K1,K2的大小,K1_________K2(填写“ >”、“=”或“<”)。
⑤在400℃时,当测得NH3和N2、H2的物质的量分别为3mol和1 mol、2 mol时,则该反应的V(H2)正_________ V (H2)逆(填写“>”、“=”或“<”)。
在密闭容器中进行反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1=akJ·mol一1
FeO(s)+CO(g) ΔH1=akJ·mol一1
反应②2CO(g)+O2(g) 2CO2(g) △H2="b" kJ·mol-1
2CO2(g) △H2="b" kJ·mol-1
反应③2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1) △H3= (用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K= ,已知500℃时反应①的平衡常数K=1.0,在此温度下2 L密闭容器中进行反应①,Fe和CO2的起始量均为2.0 mol,达到平衡时CO2的转化率为 ,CO的平衡浓度为 。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有 (填序号)。
| A.缩小容器的体积 | B.再通入CO2 |
| C.升高温度 | D.使用合适的催化剂 |
(4)下列图像符合反应①的是 (填序号)(图中V是速率、φ为混合物中CO含量,T为温度)。

(1)在一容积为10L的容器中,通入一定量的CO和H2O,在850℃时发生反应CO(g)+H2O(g) CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)= mol·L-1·min-1,850℃时,此反应的平衡常数为 ,CO的转化率为 。
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)= mol·L-1·min-1,850℃时,此反应的平衡常数为 ,CO的转化率为 。

(2) ℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
| t/min |
c(CO)/mol·L-1 |
c(H2O)/mol·L-1 |
c(CO2)/mol·L-1 |
c(H2)/mol·L-1 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
|
①从表中看出,3~4min之间反应处于 状态;c1 0.08(填“大于”、“小于”或“等于”)。
②反应在4~5min间,平衡向逆反应方向移动,可能的原因是 ,表中5~6min之间数值发生变化,可能的原因是 。
a.降低温度 b.增加水蒸气
c.增加氢气浓度 d.使用催化剂
试题篮
()