附加题
Ⅰ:如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和
1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g) 2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:

(1)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是 。
(2)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,反应化学平衡常数为____。
(3)若达到平衡时,隔板K最终停留在左侧刻度靠近0处, 则乙中可移动活塞F最终停留在右侧的刻度不大于 ;
Ⅱ:若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)测得甲中A的转化率为b,则乙中C的转化率为 ;
(2)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。
有甲乙两个容积均为1L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g) xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:
xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:
(1)甲平衡时A的体积分数为 ;
(2)若乙W%=40%,且建立平衡的过程中乙压强有变化 ,则x= ,乙中建立平衡时压强的变化为 (填“递增”或“递减”);
(3)若乙W%=40%,且平衡时甲、乙压强不同,则x= ,平衡时甲的压强 乙的压强(填“大于”或“小于”),乙平衡时c(A)= ;
(4)若x=4,则W% 40%(填“大于”、“小于”或“等于”,下同);平衡时乙中的c(A) 甲中的c(A)。
在1.0L密闭容器中放入l.0molX(g),在一定温度进行如下反应:
X(g) Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
Y(g) +Z(g)△H=akJ.mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:

回答下列问题:
(1)实验测得,随温度的升高反应的平衡常数K增大,则△H_______0(填>、<或=)
(2)其他条件不变时,为使平衡向右移动,采用的下列措施可行的是________________。
| A.缩小容器容积 |
| B.及时分离出Y、Z |
| C.使用合理的催化剂 |
| D.升高体系温度 |
(3)计算平衡时X的转化率为__________,该温度下反应的平衡常数值为:______________。
(4)由总压强p和起始压强po表示反应体系的总物质的量n(总)和反应物X的物质的量n(X),则n(总)=__ mol,n(X)=__ mol,反应物X的转化率a(X)的表达式为_____________。
Ⅰ.CO可用于合成甲醇。在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
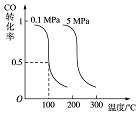
(1)该反应属于 反应(填“吸热”或“放热”)。
(2)100℃时,该反应的平衡常数:K= (用a、b 的代数式表示)。
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO,2a mol H2,达到平衡时CO转化率 (填“增大”“不变”或“减小”)
Ⅱ.T ℃时,纯水中c(OH-)为10-6 mol·L-1,则该温度时
(1)将pH=3 的H2SO4溶液与pH=10的NaOH溶液按体积比9:2 混合,所得混合溶液的pH为 。
(2)若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
Ⅲ. 在25mL的氢氧化钠溶液中逐滴加入0.2 mol/ L醋酸溶液,滴定曲线如图所示。

(1)该氢氧化钠溶液浓度为________________。
(2)在B点,a_________12.5 mL(填“<”“>”或“=”)。若由体积相等的氢氧化钠溶液和醋酸溶液混合且恰好呈中性,则混合前c(NaOH) c(CH3COOH)
(3)在D点,溶液中离子浓度大小关系为_____________________。
五氯化磷(PCl5)是有机合成中重要的氯化剂,可以有三氯化磷(PCl3)氯化得到: 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0molPCl3和1.0molCl2,一段时间后反应达平衡状态,实验数据如下表所示:
。某温度下,在容积恒定为2.0L的密闭容器中充入2.0molPCl3和1.0molCl2,一段时间后反应达平衡状态,实验数据如下表所示:
(1) 0~150s内的平均反应速率
(2) 该温度下,此反应的化学平衡常数的数值为___________(可用分数表示)。
(3) 反应至250s 时,该反应放出的热量为______________kJ。
(4) 下列关于上述反应的说法中,正确的是__________(填字母序号)。
a. 无论是否达平衡状态,混合气体的密度始终不变
b. 300s 时,升高温度,正、逆反应速率同时增大
c. 350s 时,向该密闭容器中充入氮气,平衡向正反应方向移动
d. 相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.2molCl2,达到化学平衡状态时,n(PCl5 ) < 0.20mol
(5) 温度T 1时,混合气体中PCl5 的体积分数随时间t 变化的示意图如下。其他条件相同,请在下图中画出温度为T 2(T 2> T 1)时,PCl5的体积分数随时间变化的曲线。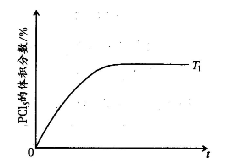
工业生产硝酸铵的流程图如下图。请回答:

(1)已知 :N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
①在500℃、2.02×107Pa和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量_____(填“<”、“>”或“=”)92.4kJ,理由是 。
②为提高氨的产量,获得更大的效益,实际生产中宜采取的措施有 。
A 降低温度 B 最适合催化剂活性的适当高温 C 增大压强
D 降低压强 E 循环利用和不断补充氮气 F 及时移出氨
(2)已知铂铑合金网未预热也会发热。写出氨催化氧化的化学方程式: ,该反应的化学平衡常数表达式K= ,当温度升高时,K值 (填“增大”、“减小”或“不变”)。
(3)在一定温度和压强的密闭容器中,将平均相对分子质量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均相对分子质量为10,请计算此时H2的转化率(写出计算过程)。
在一密闭容器中发生下列反应:2SO2 (g)+O2 (g) 2SO3(g) ΔH<0,如图所示是某一时间段中反应速率与反应进程的曲线关系。回答下列问题:
2SO3(g) ΔH<0,如图所示是某一时间段中反应速率与反应进程的曲线关系。回答下列问题:

(1)处于平衡状态的时间段是____ ____。
(2)t1、t3、t4时刻,体系中分别改变的是什么条件?
t1______ __;t3______ __;t4_____ ___。
工业生产硝酸铵的流程如下图所示

(1)硝酸铵的水溶液呈 (填“酸性”、“中性”或“碱性”);其水溶液中各离子的浓度大小顺序为: 。
(2)已知N2(g)+3H2(g) 2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。
2NH3(g) △H<0,当反应器中按n(N2):n(H2)=1:3投料,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如下图。

①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是
| A.及时分离出NH3可以提高H2的平衡转化率 |
| B.P点原料气的平衡转化率接近100%,是当前工业生产工艺中采用的温度、压强条件 |
| C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N) |
| D.M点对应的H2转化率是75% |
E.如果N点时c(NH3)=0.2 mol·L-1,N点的化学平衡常数K≈0.93
(3)尿素(H2NCONH2)是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为二步反应:第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272 kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138 kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下左图所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第__________步反应决定,总反应进行到________min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_______________mol·L-1·min-1。
③在右图中画出第二步反应的平衡常数K随温度的变化的示意图。
(1)反应N2O4(g) 2NO2(g);DH>0的平衡体系中,在298K时,平衡常数为K1,在273K时,平衡常数为K2,在373K时平衡常数为K3,K1、K2、K3之间的数量大小关系是 。
2NO2(g);DH>0的平衡体系中,在298K时,平衡常数为K1,在273K时,平衡常数为K2,在373K时平衡常数为K3,K1、K2、K3之间的数量大小关系是 。
(2)在298K时,将0.40 mol的N2O4气体充入2 L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
20~40 s内用N2O4表示的平均反应速率为________mol·L-1·s-1;298K时该反应的平衡转化率=________;反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”、“变深”或“不变”);
(3)298K时,反应2NO2(g) N2O4(g);DH<0达到平衡后,根据下列图像判断引起平衡移动的因素及平衡移动的的方向:
N2O4(g);DH<0达到平衡后,根据下列图像判断引起平衡移动的因素及平衡移动的的方向:

图(2)平衡将向_______方向移动;图(3)引起平衡移动的因素是_____________,图(4)引起平衡移动的因素是______________。
乙苯催化脱氢制苯乙烯反应: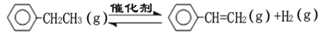
(1)已知:
| 化学键 |
C-H |
C-C |
C=C |
H-H |
| 键能/kJ·molˉ1 |
412 |
348 |
612 |
436 |
计算上述反应的△H=__________。
(2)维持体系总压强p恒定,在温度T时,物质的量为n的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的压强平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)工业上,通常在乙苯蒸汽中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
① 掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________。
② 控制反应温度为600℃的理由是____________。
(4)某研究机构用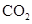 代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;已知该工艺中还能够发生反应:
代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;已知该工艺中还能够发生反应: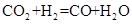 ,
,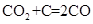 ,据此可推知新工艺的特点有_________(填编号)。
,据此可推知新工艺的特点有_________(填编号)。
①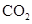 与
与 反应,使乙苯脱氢反应的化学平衡右移
反应,使乙苯脱氢反应的化学平衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利用 资源利用
资源利用
在一定条件下进行如下反应:aX(g)+bY(g) cZ(g)。下图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系示意图。
cZ(g)。下图是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系示意图。
(1)写出该反应的化学平衡常数表达式:K=________。随着温度的升高,K值________(填“增大”“减小”或“不变”)。当反应物起始浓度相同时,平衡常数K值越大,表明________(填字母)。
| A.X的转化率越高 |
| B.反应进行得越完全 |
| C.达到平衡时X的浓度越大 |
| D.化学反应速率越快 |
(2)如图所示,相同温度下,在甲、乙两容器中各投入1molX、2molY和适量催化剂,甲、乙两容器的初始体积均为1L。甲、乙容器达到平衡所用时间:甲________乙(填“>”“<”或“=”,下同),平衡时X和Y的转化率:甲________乙。
在一个固定体积为2升的密闭容器中,充入2molA和1molB,发生如下反应: 2A(g)+B(g)  3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
①2分钟内用B表示的平均反应速度为 ;
②若容器温度升高,平衡时混合气体的平均摩尔质量减小,则正反应为 (填 “吸热”或“放热”)反应。
(1)某可逆反应在不同条件下的反应历程分别为 、
、 ,如图所示。
,如图所示。

①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”);
②其中 历程表明此反应采用的条件为 (选填序号)。
历程表明此反应采用的条件为 (选填序号)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
(2)1000℃时,硫酸钠与氢气发生下列反应:

该反应的平衡常数表达式为 。
已知K1000℃ < K1200℃, 若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、“减小”或“不变”)
(3)生铁在潮湿空气中会发生吸氧腐蚀。
①电解质溶液可选用(填序号) 。
A.NaOH溶液 B.C2H5OH C.NaCl溶液 D.稀硫酸
②写出生铁在潮湿空气中吸氧腐蚀正极的电极反应式 。
(1)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛地开发和应用前景。反应: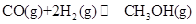
① 下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1__________0(选填“>”“=”或“<”),根据该反应特点,此反应自发进行的条件是____________(选填“高温”“低温”或“任何温度”)
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为___________。
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160。此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度见下表。
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/mol·L-1 |
0.2 |
0.1 |
0.4 |
①比较此时正、逆反应速率的大小:v正__________v逆(选填“>”“<”或“=”)
②若其他条件不变,在T2℃反应10min后达到平衡,c(H2)=0.4mol·L-1,则该时间内反应速率v(CH3OH)=_____________。
(3)已知: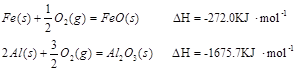
Al和FeO发生铝热反应的热化学方程式是 。
(4)已知:常温下,Ksp[Fe(OH)3]=4.0×10-38;当溶液的pH=4时, 则此溶液中Fe3+的物质的量浓度是_____________。
试题篮
()