(14分)尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下:
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。
A点的正反应速率v正(CO2)_______B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为________________________。
(2)氨基甲酸铵是合成尿素的一种中间产物。将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)  NH2COONH4(s)
NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡气体总浓度 (10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①关于上述反应的焓变、熵变说法正确的是 。
A.∆H<0, ∆S<0 B.∆H>0, ∆S<0
C.∆H>0, ∆S>0 D.∆H<0, ∆S>0
②关于上述反应的平衡状态下列说法正确的是________________
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入1 L0.1 mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052 mol氨基甲酸铵,此时溶液中几乎不含碳元素。此时溶液中c(NH4+ )= ;
NH4+ 水解平衡常数值为 。
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,写出该电池的负极反应式: 。
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+  O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
反应:Fe2O3(s)+ 3CO(g) 2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
Ⅱ.反应 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
 Fe(s)+ CO2(g)在1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
Fe(s)+ CO2(g)在1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=____________.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________.
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g) CH3OH(g).请根据图示回答下列问题:
CH3OH(g).请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________.
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的转化率 |
CH3OH的浓度 |
能量变化(Q1、Q2、Q3均大于0) |
| 甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1 kJ热量 |
| 乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2 kJ热量 |
| 丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3 kJ热量 |
则下列关系正确的是________.
A.c1=c2
B.2Q1=Q3
C.2α1=α2
D.α1+α2 =1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l mol CO、2mol H2和1mol CH3OH ,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向______(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式__________________ ____。
焦炭与CO、H2均是重要的能源,也是重要的化工原料。
(1)已知C、H2、CO的燃烧热(△H)分别为-393.5 kJ·mol-1、-285.8kJ·mol-1、-283 kJ·mol-1,又知水的气化热为+44 kJ/mol。
①焦炭与水蒸气反应生成CO、H2的热化学方程式为___________________。
②若将足量焦炭与2mol水蒸气充分反应,当吸收能量为191.7 kJ时,则此时H2O(g)的转化率为_________________。
(2)将焦炭与水蒸气置于容积为2L的密闭容器中发生反应:C(s)+H2O(g) CO(g)+H2(g),其中H2O、CO的物质的量随时间的变化曲线如图所示。
CO(g)+H2(g),其中H2O、CO的物质的量随时间的变化曲线如图所示。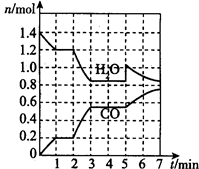
①第一个平衡时段的平衡常数是______________,若反应进行到2 min时,改变了温度,使曲线发生如图所示的变化,则温度变化为___________(填“升温”或“降温”)。
②反应至5 min时,若也只改变了某一个条件,使曲线发生如图所示的变化,该条件可能是下述中的____。
a.增加了C
b.增加了水蒸气
c.降低了温度
d.增加了压强
(3)假设(2)中反应在第2min时,将容器容积压缩至1 L,请在上图中绘制出能反映H2O、CO物质的量变化趋势的图像。
(4)若以CO、O2、K2CO3等构成的熔融盐电池为动力,电解400 mL饱和食盐水,则负极上的电极反应式为______________________,当有5·6g燃料被消耗时,电解池中溶液的pH=__________(忽略溶液的体积变化,不考虑能量的其它损耗)。
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1)已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。用1 m3(标准状况)的甲烷与水蒸气在高温下反应制取合成气所需的热量为 (保留整数)。
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
| 物质浓度 时间/min |
0 |
1 |
2 |
3 |
4 |
| CH4 |
0.2mol·L-1 |
0.13 mol·L-1 |
0.1 mol·L-1 |
0.1 mol·L-1 |
0.09 mol·L-1 |
| H2 |
0 mol·L-1 |
0.2 mol·L-1 |
0.3 mol·L-1 |
0.3 mol·L-1 |
0.33 mol·L-1 |
①计算该反应第一次达平衡时的平衡常数K 。
②3min时改变的反应条件是 (只填一种条件的改变即可)。
(3)已知温度、压强、投料比X[n(CH4)/n(H2O)]对该反应的影响如图所示。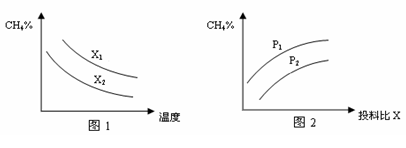
①图1中的两条曲线所示投料比的关系X1 X2(填“=”、“>”或“<”下同)。
②图2中两条曲线所示的压强比的关系:P1 P2。
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为 。
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 。
目前“低碳经济”备受关注。CO2的产生及有效开发利用成为科学家研究的重要课题。试利用所学知识,解决下列问题。
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题.试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为:_________________
它所对应的化学反应为:_________________
(2)一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如表所示:
| 容器 |
容积/L |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需的时间/min |
|
| C(s) |
H2O(g) |
H2(g) |
||||
| 甲 |
2 |
T1 |
2 |
4 |
3.2 |
8 |
| 乙 |
1 |
T2 |
1 |
2 |
1.2 |
3 |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填选项字母).
A.=0.8mol•L﹣1 B.=1.4mol•L﹣1
C.<1.4mol•L﹣1 D.>1.4mol•L﹣1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g),达到平衡时各气体的体积分数与甲容器完全相同的是 (填选项字母).
A.0.6mol、1.0mol、0.5mol、1.0mol
B.0.6mol、2.0mol、0mol、0mol
C.1.0mol、2.0mol、1.0mol、2.0mol
D.0.25mol、0.5mol、0.75mol、1.5mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
投料比[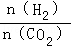 ] ] |
500K |
600K |
700K |
800K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
①该反应的焓变△H 0,熵变△S 0(填>、<或=).
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 .若以1.12L•min﹣1(标准状况)的速率向该电池中通入甲醚(沸点为﹣24.9℃),用该电池电解500mL 2mol•L﹣1 CuSO4溶液,通电0.50min后,理论上可析出金属铜 g.
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
(1)用CH4和02直接制备甲醇蒸气的热化学方程式为 。
(2)某温度下,向4 L恒容密闭容器中通人6 mol C02和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为 ,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
,则此温度下该反应的平衡常数K= ,CH4的转化率为 。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为: ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:

①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5× 106 Pa” “4.O×106 Pa”或“5.0× 106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示:
①通入a气体的电极是电池的 (填“正”或“负”)极,其电极反应式为 .
②常温下,用此电池以惰性电极电解O.5 L饱和食盐水(足量),若两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为 (忽略溶液的体积变化)。
SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体中直接排入空气时会引起酸雨的有__________(填化学式)。
(2)已知:2SO2(g)+ O2(g)=2SO3(g);△H=-196.6kJ/mol
O2(g)+2NO(g)=2NO2(g);△H=-113.0kJ/mol
①反应:NO2(g) +SO2(g)= SO3(g) +NO(g)的△H=_ kJ/mol。
②一定条件下,将NO2和SO2以体积比1:1置于恒温恒容的密闭容器中发生反应: NO2(g) +SO2(g) SO3(g) +NO(g),
SO3(g) +NO(g),
下列不能说明反应达到平衡状态的是_____(填字母)。
a.体系压强保持不变
b.混合气体的颜色保持不变
c.NO的物质的量保持不变
d.每生成1molSO3的同时消耗1molNO2
(3)CO可用于合成甲醇,其反应的化学方程式为CO(g)+2H2(g)  CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
CH3OH(g)。在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
①上述合成甲醇的反应为______(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为___________。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_____L。
(4)某研究小组设计了如图所示的甲醇燃料电池装置。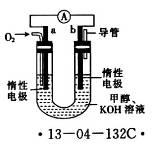
①该电池工作时,OH-向______(填“a”或“b”)极移动。
②电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为__________________。
试题篮
()