下列关于各图像的解释或结论正确的是

甲 乙 丙 丁
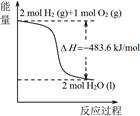
A.由甲可知:热化学方程式是H2(g) + O2(g) = H2O(g) △H=﹣241.8kJ/mol
O2(g) = H2O(g) △H=﹣241.8kJ/mol
B.由乙可知:对于恒温恒容条件下的反应2NO2(g) ⇌N2O4(g),A点为平衡状态
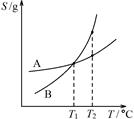
C.由丙可知:将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A
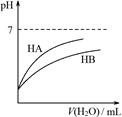
D.由丁可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是


A.该反应的化学方程式为:3X+2Y 2Z 2Z |
| B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0 |
| C.若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应 |
| D.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 |
在新制的氯水中存在平衡:Cl2+H2O HCl+HClO。加入少量下列物质能使c(HClO)增大的是
HCl+HClO。加入少量下列物质能使c(HClO)增大的是
| A.CaCO3 | B.NaOH | C.CaSO3 | D.HCl |
工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应经过20分钟在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应经过20分钟在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为 计算:
计算:
(1)H2在20分钟内的平均反应速率为 ;
(2)该条件下N2的平衡转化率为 ;(小数点后保留一位)
(3)该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数为 。(不带单位)
N2(g)+3H2(g)的平衡常数为 。(不带单位)
(1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图(反应物O2(g)和生成物H2O(g)略去)。

①在有催化剂作用下,CH3OH与O2反应主要生成 ;(填“CO、CO2”或“HCHO”)
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g)△H= ;
(2)已知:CO(g)+2H2(g)⇌CH3OH(g)△H=﹣a kJ•mol﹣1.
经测定不同温度下该反应的平衡常数如下:
| 温度(℃) |
250 |
300 |
350 |
| K |
2.041 |
0.270 |
0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4mol•L﹣1、c(H2)=0.4mol•L﹣1、c(CH3OH)=0.8mol•L﹣1,则此时V正 V逆(填“>”、“<”或“=”)。
已知反应①:CO(g)+CuO(s)⇌CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)⇌Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是
A.反应①的平衡常数K1= |
B.反应③的平衡常数 |
| C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应为吸热反应 |
| D.对于反应②,恒温恒容下,增大压强,H2浓度一定增大 |
草酸(H2C2O4)是一种二元弱酸,广泛分布于动植物体中。
(1)人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一。有研究发现,EDTA(一种能结合金属离子的试剂)在一定条件下可以有效溶解结石,用化学平衡原理解释其原因: 。
(2)已知:0.1 mol·L-1KHC2O4溶液呈酸性。下列说法正确的是 (填字母序号)。
a. 0.1 mol·L-1KHC2O4溶液中:c(K+) + c(H+) = c(HC2O4-) + 2c(C2O42-) + c(OH-)
b. 0.1 mol·L-1 KHC2O4溶液中:c(K+) > c(HC2O4-) > c(C2O42-) > c(H2C2O4)
c. 浓度均为0.1 mol·L-1 KHC2O4和K2C2O4的混合溶液中:2c(K+) = c(HC2O4-) + c(C2O42-)
d. 0.1 mol/L KHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+) > c(Na+)
(3)利用草酸制备草酸亚铁晶体(FeC2O4·xH2O)的流程及组分测定方法如下:
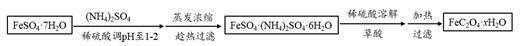
已知:i. pH>4时,Fe2+易被氧气氧化
ii. 几种物质的溶解度(g /100g H2O)如下
| |
FeSO4·7H2O |
(NH4)2SO4 |
FeSO4·(NH4)2SO4·6H2O |
| 20℃ |
48 |
75 |
37 |
| 60℃ |
101 |
88 |
38 |
①用稀硫酸调溶液pH至1~2的目的是: , 。
②趁热过滤的原因是: 。
③氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M)。称取a g草酸亚铁晶体溶于稀硫酸中,用b mol·L-1的高锰酸钾标准液滴定,到达滴定终点时,消耗高锰酸钾VmL,则M = 。(已知:部分反应产物为Mn2+、Fe3+、CO2)
已知反应2CH3OH(g) CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
下列说法正确的是
A.a = 1.64
B.此时刻正反应速率大于逆反应速率
C.若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大
D.若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。
Ⅰ.定性实验方案如下:
(1)将SO2通入水中形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为_______________。
(2)利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:
实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_________________________。
Ⅱ.定量实验方案如下(部分装置和操作略):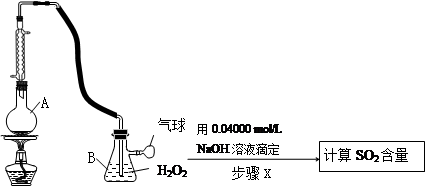
(3)仪器A的名称是________________。
(4)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为______________。
(5)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定, 除去H2O2的方法是__________。
(6)步骤X滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为__________g/L。该测定结果比实际值偏高,分析原因________________________。
大气中的部分碘源于O3对海水中I¯的氧化。某科学小组进行O3与含I¯溶液反应的相关研究。
(1)O3将I¯氧化生成I2的过程由3步反应组成:
① I¯(aq)+ O3(g)="==" IO¯(aq)+O2(g) △H1
② IO¯(aq)+H+(aq) HOI(aq) △H2
HOI(aq) △H2
③ HOI(aq) + I¯(aq) + H+(aq) I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
用热化学方程式表示O3氧化I¯生成I2的反应____________________。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半时所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
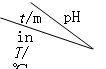 |
3.0 |
4.0 |
5.0 |
6.0 |
| 20 |
301 |
231 |
169 |
58 |
| 30 |
158 |
108 |
48 |
15 |
| 50 |
31 |
26 |
15 |
7 |
① 在30℃、pH=4.0条件下,O3的分解速率为__________mol/(L·min)。
② pH增大能加速O3分解,表明对O3分解起催化作用的是___________。
③ 根据表中数据,推测O3在下列条件下分解速率依次增大的顺序为_________(填字母代号)。
a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0
(3)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)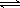 I3-(aq)。测得不同温度下该反应的平衡常数如图1所示,下列说法正确的是_____________。
I3-(aq)。测得不同温度下该反应的平衡常数如图1所示,下列说法正确的是_____________。
A.反应I2(aq)+I-(aq)  I3-(aq)的ΔH>0
I3-(aq)的ΔH>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述平衡体系中加入苯,平衡不移动
D.25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
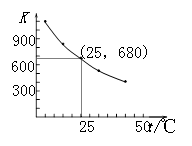

图1 图2
(4)将I2溶于CCl4中,得到紫红色的溶液,再加入一定浓度的KI溶液,现象如图2所示:
①上层溶液中含碘元素的微粒有____________________(用化学符号表示)。
②由实验现象可推测关于I2溶解性的结论是_________________________。
利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g) CH3OH(g)。在体积一定的密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g)。在体积一定的密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
A.该反应的△H<0,且p1<p2
B.反应速率:ν逆(状态A)>ν逆(状态B)
C.在C点时,CO转化率为75%
D.在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
已知2SO2(g)+O2 (g) 2SO3(g);△H=-197kJ•mol-1.向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3.恒温、恒容下反应达平衡时,下列关系一定正确的是( )
2SO3(g);△H=-197kJ•mol-1.向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3.恒温、恒容下反应达平衡时,下列关系一定正确的是( )
| A.容器内压强P:P甲=P丙>2P乙 |
| B.SO3的质量m:m甲=m丙>2m乙 |
| C.c(SO2)与c(O2)之比k:k甲=k丙>2k乙 |
| D.反应放出或吸收热量的数值Q:Q甲=197-Q丙>2Q乙 |
己知某密闭容器中发生反应:X(g)+Y(g)=2W(g)+Z(g) △H<0(Y物质易被液化)。下列有关说法中一定正确的是
| A.若W为有颜色的物质,达到平衡后,增大压强,体系颜色变浅 |
| B.平衡时其它条件不变,升高温度,正反应速率增大程度比逆反应率增大程度小 |
| C.平衡时,其它条件不变,分离出Z,正反应速率加快 |
| D.若在原电池中进行,反应放出的热量不变 |
T ℃、2L密闭容器中某一反应在不同时刻的各物质的量如图所示(E为固体,其余为气体)。

回答下列问题:
(1)写出该反应的化学方程式: 。
(2)反应开始至3 min时,用D表示的平均反应速率为 mol·L-1·min-1。
(3)T ℃时,该反应的化学平衡常数K= 。
(4)第6 min时,保持温度不变,将容器的体积缩小至原来的一半,重新达到平衡后,D的体积分数为 。
(5)另有一个2 L的密闭容器,T ℃、某一时刻时,容器中各物质的量如下表所示:
| 物质 |
A |
B |
D |
E |
| 物质的量(mol) |
0.8 |
1.0 |
0.4 |
0.2 |
此时v(正) v(逆)(填“>”或“﹦”或“﹤”)。
试题篮
()