一定条件下,在一个容积为2L的密闭容器中加入0.8mol A2气体和0.6mol B2气体反应达平衡生成1mol AB气体并释放出热量,反应中各物质的浓度随时间的变化情况如图所示.下列说法不正确的是( )

| A.图中a点的值为0.15 |
| B.该反应的平衡常数K=0.03 |
| C.温度升高,平衡常数K值减小 |
| D.平衡时A2的转化率为62.5% |
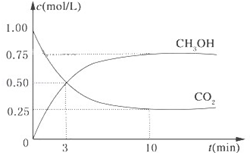
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L•min);
(2)氢气的转化率= _____;
(3)该反应的平衡常数为 _____(保留小数点后2位);
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是 ___。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 | D.再充入1mol H2 |
(5)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1 c2的关系(填“>”、“<”或“=”)
高温下,某可逆反应达到平衡,其平衡常数为K= ,恒容时,升高温度,H2的浓度减小,则下列说法正确的是( )
,恒容时,升高温度,H2的浓度减小,则下列说法正确的是( )
| A.该反应的焓变为正值 |
| B.升高温度,K值减小 |
| C.升高温度,逆反应速率减小 |
D.该反应的化学方程式为CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g) |
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) 2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

| A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对化学平衡的影响,且甲的催化效率比乙高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
下列事实,不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
B.对2HI(g) H2(g)+I2(g),平衡体系增大压强可使颜色变深 H2(g)+I2(g),平衡体系增大压强可使颜色变深 |
C.反应CO+NO2 CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 |
| D.合成NH3反应为放热反应,为提高NH3的产率,理论上应采取低温的措施 |
已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(CH3OH)]2,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
请回答下列问题:
(1)写出上述反应的化学方程式 .
(2)该反应的正反应是 反应(填“放热”或者“吸热”)
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:

①此时系统温度400℃,比较正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”).
②若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中 点.比较图中B、D两点所对应的正反应速率B D(填“>”、“<”或 “=”).理由是 .
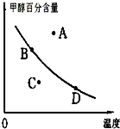
(4)一定条件下要提高反应物的转化率,可以采用的措施是
a.升高温度 b.加入催化剂
c.压缩容器的体积 d.增加水蒸气的浓度
e.及时分离出产物.
向2.0L恒容密闭容器中充入1.0mol PCl5,在温度为T时发生如下反应PCl5(g)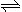 PCl3(g)+ Cl2(g)△H=" +124" kJ•mol-1。反应过程中测定的部分数据见下表:
PCl3(g)+ Cl2(g)△H=" +124" kJ•mol-1。反应过程中测定的部分数据见下表:

回答下列问题:
(1)反应在前50s的平均速率v(PCl5)= ,该反应的△S 0(填“<”、“>”或“=”).
(2)温度为T时,该反应的化学平衡常数= 。
(3)上述反应到达平衡状态时,PCl3的体积分数为 。
要提高平衡时PCl3的体积分数,可采取的措施有 。
| A.温度不变,压缩容器体积增大压强 | B.使用高效催化剂 |
| C.温度和体积不变,减小PCl5的起始量 | D.体积不变,提高反应温度 |
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a= 。
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是 。
密闭容器中,反应xA(g) + yB(g)  zC(g)达平衡时,A的浓度为0.5mol/L, 若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是( )
zC(g)达平衡时,A的浓度为0.5mol/L, 若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是( )
| A.x+y < z | B.平衡向正反应方向移动 |
| C.B的转化率升高 | D.C的体积分数下降 |
已知反应:2CH3COCH3(l)⇌CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y﹣t)如图所示.下列说法正确的是( )

| A.b代表0℃下CH3COCH3的Y﹣t曲线 |
B.反应进行到20min末,CH3COCH3的 |
| C.升高温度可缩短反应达平衡的时间并能提高平衡转化率 |
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的 |
下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅(Cl2+H2O Cl-+HClO+H+) Cl-+HClO+H+) |
| B.H2、I2、HI平衡混合气加压后颜色变深 |
| C.在合成氨的反应中,降温或加压有利于氨的合成 |
| D.Fe(SCN)3溶液中加入6mol/LNaOH溶液后颜色变浅 |
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)⇌Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )

| A.往平衡体系中加入金属铅后,C(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
| A.N2O4的消耗速率与NO2的生成速率之比为1∶2; |
| B.烧瓶内气体的颜色不再加深; |
| C.烧瓶内气体的平均相对分子质量不再变化; |
| D.烧瓶内气体的压强不再变化。 |
试题篮
()