某一可逆反应的反应物和生成物都是气体,改变下列条件一定能使化学平衡向正反应方向移动的是
| A.恒压下充入稀有气体 | B.减小反应容器的体积 |
| C.升高反应温度 | D.分离出生成物 |
下列措施或事实能用勒夏特列原理解释的是
| A.新制的氯水在光照下颜色逐渐变浅 |
| B.H2、I2、HI平衡混合气缩小体积加压后颜色变深 |
| C.工业上生产硫酸的过程中,SO2在催化氧化时条件控制为常压,而不是高压 |
| D.工业上合成氨气时温度选择450℃左右,而不是常温 |
反应N2(g)+3H2(g) 2NH3(g) DH<0;若升温, 则反应速率v(正)、v(逆)的变化是
2NH3(g) DH<0;若升温, 则反应速率v(正)、v(逆)的变化是
| A.同时减少 | B.同时增大 |
| C.v(正)增大,v(逆)减少 | D.v(正)减少,v(逆)增大 |
化学在生产和生活中有着重要的应用。下列说法不正确的是
| A.炼铁时增大高炉的高度,能有效减少CO的排放 |
| B.明矾在水处理中可作净水剂 |
| C.热电厂进行燃煤时将煤块压碎以提高煤的燃烧效率 |
| D.在海轮外壳上镶嵌锌块,能减缓船体的腐蚀速率 |
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡的是___________;
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数___________;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量___________(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H______0;
(2)已知:NH2COONH4+2H2O⇌NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率______________;
⑥根据图中信息,如何说明水解反应速率随温度升高而增大_____________________。
在一定条件下,可逆反应A+B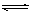 mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后容器加压的变化情况,问: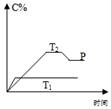
(1)温度T1 _____T2(填大于、等于或小于);
(2)正反应是__________反应(填“吸热”或“放热”);
(3)如果A、B、C均为气体,则m_____2(填大于、等于或小于);
(4)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则体系的压强_____(“增大”、“减小”或“不变”),平衡_______移动;当温度和压强不变时,如在平衡体系中加入一定量的某稀有气体,平衡_______移动(填“向正反应方向”“向逆反应方向”或“不”)。
已知2A2(g)+B2(g)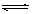 2C3(g) △H=" -a" kJ•mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为w mol/L,放出热量b kJ;
2C3(g) △H=" -a" kJ•mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为w mol/L,放出热量b kJ;
(1)比较a __________b( 填>、=、<);
(2)若将反应温度升高到700℃,反应的平衡常数将_________(增大、减小或不变);
(3)能说明该反应已经达到平衡状态的是______
a.V(C3)=2V(B2); b.容器内压强保持不变
c.V逆(A2)=2V正(B2) d.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_________
a.及时分离出C3气体; b.适当升高温度; c.增大B2的浓度; d.选择高效的催化剂
研究NO2、SO2、CO等大气污染气体的处理具有重大意义。
(1)NO2可用水吸收,相应的化学反应方程式为_________________________;利用反应6NO2+8NH3═7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是____________L。
(2)已知:
2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)⇌2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的△H="_______" kJ•mol-1
(3)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_______(填序号)
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=_______。
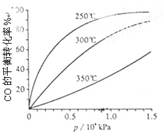
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)═CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如下图所示.该反应△H_____(填“>”或“<”),实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是_______。
某恒温密闭容器中,可逆反应A(s) B+C(g) △H="Q" kJ•mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是( )
B+C(g) △H="Q" kJ•mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是( )
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量小于Q kJ
在80℃时,某物质在2L的容器中发生化学反应,隔一段时间对该容器内的物质进行分析,得到下表数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(NO2) |
0.00 |
0.48 |
b |
1.04 |
1.2 |
1.2 |
| n(N2O4) |
0.80 |
a |
0.40 |
c |
d |
e |
则下列说法正确的是( )
A.该反应的方程式为2NO2 N2O4
N2O4
B.80s前该反应一定没有达到平衡状态
C.a的取值为0.56
D.20s到40s内用N2O4表示的反应速率为0.010mol•L-1•S-1
向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g) 2NH3(g) △H<0达到平衡,n(NH3)和n(H2)随时间变化的关系如图所示。下列有关叙述正确的是( )
2NH3(g) △H<0达到平衡,n(NH3)和n(H2)随时间变化的关系如图所示。下列有关叙述正确的是( )
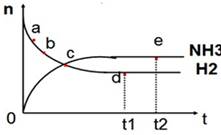
| A.c点表示NH3生成速率与NH3分解速率相同 |
| B.c点和e点时反应的平衡常数相同 |
| C.N2的转化率:b>a |
| D.d点时,n(N2):n(H2):n(NH3)=1:3:2 |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) △H=" -92" kJ•mol-1。
2NH3(g) △H=" -92" kJ•mol-1。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
2 |
3 |
0 |
放出热量b kJ |
| ③ |
2 |
6 |
0 |
放出热量c kJ |
下列叙述正确的是( )
A.放出热量关系:a<b<92.4
B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③
D.N2的转化率:②>①>③
下列叙述中能判断某化学平衡发生移动的是( )
| A.混合物中各组分的浓度改变 |
| B.正、逆反应速率改变 |
| C.混合物中各组分的含量改变 |
| D.混合体系的压强发生改变 |
试题篮
()