A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2  N2O4;△H<0)
N2O4;△H<0)

(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_______VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将___________(填:变大、变小、不变)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将______(填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将_____,B中NO2的转化率将_______(填: 变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,___________中的颜色较深。
可逆反应:3A(g)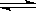 3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是
3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是
| A.若C为固体,则B一定是气体 | B.B和C一定都是气体 |
| C.B和C可能都是固体 | D.B和C不可能都是气体 |
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是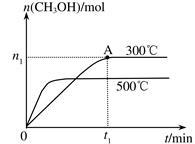
| A.该反应的△H>0 |
| B.其他条件不变,升高温度反应的平衡常数增大 |
| C.300℃时,0-t1min内 CH3OH的平均生成速率为n1/2t1 mol·L-1 min-1 |
| D.A点的反应体系从300℃升高到500℃,达到平衡时n(H2)/n(CH3OH)减小 |
如图所示曲线表示其他条件一定时,反应:2NO+O2 2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
| A.a点 | B.b点 |
| C.c点 | D.d点 |
一定温度下,可逆反应2NO2(g)  2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
| A.①④⑤⑥ | B.①②③⑤ | C.②③④⑥ | D.以上全部 |
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y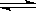 2Z,其平衡常数为1600(mol/L) -2
2Z,其平衡常数为1600(mol/L) -2
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
在一密闭容器中,反应aA(g)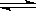 bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
| A.平衡向逆反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增加了 | D.a>b |
在相同的
A.B密闭容器中分别充入2 mol SO2和1 mol O2,使它们在一定温度下反应,并达新平衡:2SO2+O2 2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为 2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为A.25% |
B.大于25% | C.小于25% | D.无法判断 |
己知N2(g)+3H2(g) 2NH3(g)△H=﹣92.4kJ•mo1﹣1,下列结论正确的是
2NH3(g)△H=﹣92.4kJ•mo1﹣1,下列结论正确的是
| A.在密闭容器中加入1mol N2和3mol H2充分反应放热92.4kJ |
B.N2(g)+3H2(g) 2NH3(l)△H=﹣QkJ•mo1﹣1,则Q>92.4 2NH3(l)△H=﹣QkJ•mo1﹣1,则Q>92.4 |
| C.增大压强,平衡向右移动,平衡常数增大 |
| D.若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率为60% |
在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是
CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是
| A.10 min时,改变的外界条件可能是升高温度 |
| B.0~10 min内,v(H2)=0.15 mol·L-1·min-1 |
| C.恒温下,缩小容器体积,一段时间内v(逆)>v(正) |
| D.12 min时,反应达平衡的本质原因是气体总质量不再变化 |
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g) COS(g)+H2(g) K=0.1反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
COS(g)+H2(g) K=0.1反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
| A.升高温度,H2S浓度增加,表明该反应是吸热反应 |
| B.通入CO后,正反应速率逐渐增大 |
| C.反应前H2S物质的量为7mol |
| D.CO的平衡转化率为80% |
二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成:
2H2(g)+CO(g)  CH3OH(g) ΔH=" —90.0" kJ·mol-1 ①
CH3OH(g) ΔH=" —90.0" kJ·mol-1 ①
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=" —24.5" kJ·mol-1 ②
CH3OCH3(g)+H2O(g) ΔH=" —24.5" kJ·mol-1 ②
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=" —41.1" kJ·mol-1 ③
CO2(g)+H2(g) ΔH=" —41.1" kJ·mol-1 ③
(1)反应①的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下该反应自发进行。
(2)在250℃的恒容密闭容器中,下列事实可以作为反应③已达平衡的是 (填选项字母)。
| A.容器内气体密度保持不变 | B.CO与CO2的物质的量之比保持不变 |
| C.H2O与CO2的生成速率之比为1∶1 | D.该反应的平衡常数保持不变 |
(3)当合成气中CO与H2的物质的量之比恒定时,温度、压强对CO转化率的影响如图1所示。图1中A点的v(逆) B点的v(正)(填“>”、“<”或“=”),说明理由 。实际工业生产中该合成反应的条件为500℃、4MPa请回答采用500℃的可能原因 。


(4)一定温度下,密闭容器中发生反应③,水蒸气的转化率与n(H2O)∕n(CO)的关系如图:计算该温度下反应③的平衡常数K= 。在图2中作出一氧化碳的转化率与n(H2O)∕n(CO)的曲线。
在25℃下,已知反应:①NH3·H2O+H+ NH4+ + H2O(平衡常数为K1);
NH4+ + H2O(平衡常数为K1);
②Ag++2 NH3·H2O Ag(NH3)2++ 2H2O(平衡常数为K2),且K1> K2。下列说法不合理的是
Ag(NH3)2++ 2H2O(平衡常数为K2),且K1> K2。下列说法不合理的是
A.25℃时,将0.02 mol·L-1的氨水与a mol·L-1的盐酸等体积混合(体积变化忽略不计),反应后溶液呈中性,则用含a的代数式表示NH3·H2O的电离常数为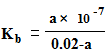 |
| B.往银氨溶液中加水稀释,反应②平衡向逆反应方向移动 |
| C.若往银氨溶液中加入足量的盐酸,则溶液中会产生白色浑浊 |
| D.已知:H+(aq)+ OH-(aq)=H2O(l)DH = -57.3 kJ·mol-1,则1 L 0.1 mol ·L-1氨水和足量的盐酸反应放出的热量等于5.73 kJ |
已知反应:2NO2 (红棕色)  N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,下右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,下右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是

| A.b点的操作是拉伸注射器 |
| B.d 点:v(正) < v(逆) |
| C.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| D.若不忽略体系温度变化,且没有能量损失,则温度关系:T(b)>T(c) |
试题篮
()