下列叙述中,不能用勒夏特列原理解释的是
| A.红棕色的NO2加压后颜色先变深后略变浅 |
| B.在H2O2溶液中加入MnO2后产生气泡的速率加快 |
| C.合成氨时及时将氨从反应体系中分离出去,可提高原料的利用率 |
| D.打开汽水瓶,看到大量的气泡逸出 |
一定条件下,容积为2 L的恒容密闭容器中,通入2 mol N2、3 mol H2进行反应
N2(g)+3H2(g) 2NH3(g),20 min后,N2的物质的量为1.9 mol,1 h后测得容器内气体的压强不再改变,且为反应开始时压强的0.8倍,则下列叙述正确的是
2NH3(g),20 min后,N2的物质的量为1.9 mol,1 h后测得容器内气体的压强不再改变,且为反应开始时压强的0.8倍,则下列叙述正确的是
| A.当容器内压强不改变时,说明反应已达到平衡状态 |
| B.增加H2的浓度或降低温度,平衡将向正反应方向移动,且反应速率均加快 |
| C.前20 min用NH3表示的反应速率为0.01 mol·L-1·min-1 |
| D.1 h后反应进行完全,容器中的N2浓度为0.55 mol·L-1 |
右图是关于反应A2(g)+3B2(g)="==2C(g)" △H<0的平衡移动图形,
影响平衡移动的原因是
| A.升高温度,同时加压。 |
| B.降低温度,同时减压 |
| C.增大反应物浓度,同时使用催化剂; |
| D.增大反应物浓度,同时减小生成物浓度 |
在温度一定的条件下,向一密闭容器中加入4mol SO2和3 mol O2,发生反应:2 SO2 (g) + O2 (g)  2 SO3 (g) △H<O,达到平衡后,生成了a mol SO3。
2 SO3 (g) △H<O,达到平衡后,生成了a mol SO3。
(1) 温度升高,该反应的化学平衡常K值___________(填增大、减小、可能增大也可能减小)。
(2)SO2的转化率为 (用字母a的表达式表示)
(3)若该反应是在恒温恒压的密闭容器中进行的。现加入8mol SO2和6mol O2,达到平衡后SO3气体的物质的量为  mol (用字母a表示)。如在同样的条件下,加入3mol SO2、3mol O2、x molSO3气体,达平衡后SO3在反应混合气中的体积分数与原平衡相同,则x= ,平衡后SO3的物质的量是 mol。(用含a的表达式表示)
mol (用字母a表示)。如在同样的条件下,加入3mol SO2、3mol O2、x molSO3气体,达平衡后SO3在反应混合气中的体积分数与原平衡相同,则x= ,平衡后SO3的物质的量是 mol。(用含a的表达式表示)
I2在KI溶液中存在平衡:
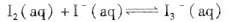 ,某I2、KI混合溶液中,c(
,某I2、KI混合溶液中,c(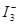 )与温度T的平衡曲线图如下。下列说法不正确的是
)与温度T的平衡曲线图如下。下列说法不正确的是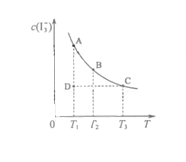
A.反应 的△H>0 的△H>0 |
B.若温度为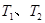 ,反应的平衡常数分别为 ,反应的平衡常数分别为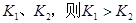 |
C.若反应进行到状态D时,一定有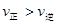 |
| D.状态A与状态B相比,状态A的c(I2) 小 |
在0.1 mol/L氨水中,分别加入少量下列物质,溶液中的c(OH-)如何变化?(填“增大”、“减小”或“不变”)
⑴加少量HNO3溶液____________ ⑵加少量KOH溶液___________
⑶加少量(NH4)2SO4固体__________ (4)加大量水__________
下列事实中,能用勒夏特列原理解释的是
| A.配制FeSO4溶液时,加入一些铁粉 |
| B.500℃左右比室温更有利于合成氨的反应 |
| C.实验室常用排饱和食盐水的方法收集氯气 |
| D.由H2、I2(g)、HI组成的平衡体系,加压后颜色加深 |
反应A(g) + B(g)  C(g) + D(g) 发生过程中的能量变化如右图,△H 表示反应的焓变。下列说法正确的是
C(g) + D(g) 发生过程中的能量变化如右图,△H 表示反应的焓变。下列说法正确的是

| A.该反应为吸热反应 |
| B.反应体系中加入催化剂,反应速率增大,E1减小,E2增大 |
| C.反应体系中加入催化剂,反应速率增大,△H不变 |
| D.反应达到平衡时,降低温度,A的转化率增大 |
一定温度下,在2L密闭容器中充入N2和H2合成NH3,其起始浓度分别为:c(N2)=2mol/L,c (H2 ) =3mol/L,此时压强为5.05×105Pa, 达平衡后测得NH3占总体积的25%。(1)求平衡时的压强;(2)平衡时混合气体对H2的相对密度。
对化学反应限度的叙述,错误的是( )
| A.任何可逆反应都有一定的限度 |
| B.化学反应的限度是不可改变的 |
| C.化学反应的限度与时间的长短无关 |
| D.化学反应达到限度时,正逆反应速率相等 |
可逆反应2SO2 (g)+ O2 (g)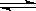 2SO3(g)达到平衡的标志是
2SO3(g)达到平衡的标志是
① 消耗2 mol SO2的同时生成2 mol SO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③ 反应混合物中,SO3的质量分数不再改变
| A.①② | B.①③ | C.只有③ | D.只有① |
一定条件下,对于可逆反应X(g)+3Y(g)  2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
| A.c1∶c2=3∶1 |
| B.平衡时,Y和Z的生成速率之比为2∶3 |
| C.X、Y的转化率不相等 |
| D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1 |
试题篮
()