设 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是
A.23 g钠与足量氧气充分反应,转移的电子个数为 |
B.1mol Cl2与水充分反应,转移的电子个数为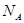 |
| C.1mol Na2O2与水完全反应时转移电子数为2NA |
| D.18 g H2O含有的电子数为18NA |
下列各溶液中,Na+物质的量浓度最大的是
A.1 L 0.3mol/L Na2SO4溶液 |
B.1 L 0.3mol/L NaCl溶液 |
| C.2 L 0.4mol/L NaOH溶液 | D.2 L 0.15mol/L Na3PO4溶液 |
与1mol NH3所含有的分子数目相同的是
| A.0.5mol O2 | B.1mol Fe | C.2mol H2 | D.2mol H2O |
设NA为阿伏加德罗常数的值,下列判断正确的是 ( )
| A.含4molHCl的浓盐酸与足量MnO2混合加热,产生NA个Cl2 |
| B.标准状况下,22.4L己烷中共价键数为19NA |
| C.0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3 NA |
| D.氧气和臭氧组成的4.8g混合气体中含有0.3 NA个氧原子 |
下列说法正确的是(N0表示阿伏加德罗常数的值)
| A.在常温常压下,11.2L氯气含有的分子数为0.5N0 |
| B.在常温常压下,1mol氦气含有的原子数为2N0 |
| C.32g氧气含原子数目为2N0 |
| D.在标准状况下,1mol的水含有的体积约为22.4L |
下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是
| A.该硫酸试剂的物质的量浓度为18.4 mol·L-1 |
| B.该硫酸与等体积的水混合所得溶液的质量分数小于49% |
| C.配制200.0 mL 4.6 mol·L-1的稀硫酸需取该硫酸50.0 mL |
| D.2.7 gAl与足量的该硫酸反应可得到标准状况下的H2 3.36 L |
设NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.4.6 g乙醇中含有的C-H键的个数为0.6NA |
| B.34 g H2O2中含有的阴离子数为NA |
| C.标准状况下,11.2 L CHCl3中含有的分子数为0.5NA |
| D.常温常压下,21 g氧气和27 g臭氧中含有的氧原子总数为3NA |
标准状况下V L氨气溶解在1 L的水中(水的密度近似为1 g/ml),所得溶液的密度为p g/ml,质量分数为W,物质的量浓度为c mol/L,则下列关系中不正确的是
| A.c=1000Vp/(17V+22400) | B.W=17c/(1000p) |
| C.W=17V/(17V+22400) | D.p=(17V+22400)/(22.4+22.4V) |
下列数量的各物质所含的原子数按由大到小顺序排列正确的是
①0.5molNH3 ②标准状况下22.4L氦气(He) ③4℃时9mL水 ④0.2molNa3PO4
| A.①③④② | B.①④③② | C.④③②① | D.②③④① |
某学生配制一定物质的量浓度的氢氧化钠溶液后,经测定发现溶液浓度偏低。该学生得出了以下原因,其中是使溶液浓度偏低的原因的是
| A.容量瓶刚用氢氧化钠溶液润洗过 |
| B.在转移溶液时不小心洒落瓶外 |
| C.在烧杯中溶解了氢氧化钠后,趁热将溶液到入容量瓶,并迅速配成了溶液 |
| D.定容时,俯视刻度线 |
224mL某气体在标准状况下的质量为0.32g,该气体的摩尔质量约为
?
| A.32g·mol-1 | B.32 | C.64g·mol-1 | D.64 |
下列溶液中CL-浓度与50 ml 1mol·l-1ALCL3溶液中CL-浓度相等的是
| A.150ml 1mol·l-1的NaCL溶液 | B.75ml 2mol·l-1NH4CL溶液 |
| C.150ml 2mol·l-1的KCL溶液 | D.75ml 1mol·l-1FeCL3溶液 |
将标准状况下NO2和O2按体积比4∶1混合后充入一干燥烧瓶中,把烧瓶倒置于水中,瓶内液体逐渐上升,假设烧瓶内溶液不扩散,最终烧瓶内溶液溶质的物质的量浓度为
将等物质的量的镁和铝混合均匀,再将混合物均分为四份,分别加入足量的下列溶液,充分反应后,放出氢气最多的是 ( )
| A.4mol/L HNO3溶液 | B.8mol/L NaOH溶液 |
| C.3mol/L HCl溶液 | D.18mol/LH2SO4溶液 |
试题篮
()