具有相同数目氧原子的SO2和SO3,下列关系中一定正确的是
| A.n(SO2): n(SO3) ="" 2:3 | B.V(SO2): V(SO3) =" 3:2" |
| C.m(SO2): m(SO3) ="" 6:5 | D.Mr(SO2) : Mr(SO3) = 5:4 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.1L0.5 mol·L-1 HCl溶液中含有3.01×1023个离子 |
| B.标准状况下,22.4 L H2O中所含分子数为NA |
| C.46gNO2和N2O4混合气体中含有原子数为3 NA |
| D.0.1 mol Fe和足量的稀硝酸充分反应,转移电子数为0.2 NA |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是
( )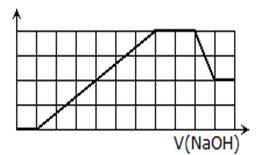

| A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ |
| B.原溶液中一定含有SO42-和Na+ |
| C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| D.反应最后形成的溶液中含有的溶质为Na2SO4 |
以NA表示阿伏伽德罗常数,下列说法正确的是
| A.1molNH4+含有10NA个质子 |
| B.T℃时1LpH=6的纯水中,含10—6NA个OH— |
| C.78gNa2O2离子化合物中含阴离子的个数是2NA |
| D.0.01molMg在CO2中燃烧转移电子数为0.01NA |
一定温度下,影响一定质量气体体积大小的决定因素是
| A.气体的密度 | B.气体分子体积的大小 |
| C.气体分子间的平均距离 | D.气体的相对分子质量 |
NA表示阿伏加德罗常数,下列说法正确的是
| A.1mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子 |
| B.1mol Al分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移的电子均为3NA个 |
| C.各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
| D.2.7 g铝与足量的NaOH溶液反应,转移的电子总数为NA |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A.标况下,5.6 L乙烯和丙烯的混合气体中含有0.25 NA个碳碳双键 |
| B.0.05 mol熔融的KHSO4中含有阳离子数目为0.10 NA |
| C.6.4 g CaC2晶体中含有的阴阳离子总数为0.3 NA |
| D.电解饱和NaCl溶液,转移0.1 NA个电子时阳极得到0.1 g H2 |
下列叙述正确的是( )
| A.同温同压下,NO和O2的混合气体与等体积的N2所含原子数相等 |
| B.16 g CH4与18 g NH+4所含质子数相等 |
| C.常温常压下,28 g CO与22.4 L O2所含分子数相等 |
| D.等物质的量的甲基与羟基所含电子数相等 |
.在25℃时,10mL pH=a的盐酸中,滴加pH=b的NaOH溶液100 mL时,溶液中Cl-的物质的量恰好等于Na+的物质的量,则a+b的值是
| A.13 | B.14 | C.15 | D.无法确定 |
将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子总浓度的大小顺序是(溶液体积变化忽略不计):①Na2O2 ②Na2O ③Na2CO3 ④NaCl
| A.①>②>③>④ | B.①>②>④>③ | C.①=②>③>④ | D.①=②>③=④ |
 表示阿伏加德罗常数,下列说法正确的是 ( )
表示阿伏加德罗常数,下列说法正确的是 ( )
A.氟气与水反应生成1moL 共转移 共转移 个电子 个电子 |
B.标准状况下 个 个 分子的质量与 分子的质量与 气体的质量大致相等 气体的质量大致相等 |
C.含 个负电荷的 个负电荷的 离子的质量为40g 离子的质量为40g ,则 ,则 的摩尔质量为32g·mol–1 的摩尔质量为32g·mol–1 |
D.25℃时,pH=13的烧碱溶液中约含 个氢氧根( 个氢氧根( )离子 )离子 |
在标准状况下,将V L 某气体(摩尔质量是M g/mol)溶于0.1 L水中(无化学反应),所得溶液的密度为d g/cm3,则此溶液的物质的量浓度为
A. |
B. |
C. |
D. |
NA表示阿伏加德罗常数,下列说法正确的是
| A.5.6g铁与足量的盐酸或氯气反应,电子转移总数均为0.3NA |
| B.25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA |
| C.46gNO2或46gN2O4所含原子数均为3NA |
| D.1 mol A1放入足量的冷浓HNO3中或稀HNO3中,反应转移的电子数均为3NA |
试题篮
()