少量铁与足量稀硫酸反应,下列方法可以加快铁与稀硫酸反应速率且不影响氢气生成
量的是( )
| A.加入少量NaSO4(aq) | B.加入少量CuSO4固体 | C.加铜屑 | D.增大压强 |
在2A+B 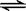 3C+4D中,表示该反应速率最快的是( )
3C+4D中,表示该反应速率最快的是( )
A.υ(A) = 0.5mol·L-1·S-1 B.υ(B) =" 0.3" mol·L-1·S-1
C.υ(C) = 0.8mol·L-1·S-1 D.υ(D)=" 1" mol·L-1·S-1
反应A(g)+3B(g)  2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
A.υ(D)="0.4" mol / (L·s) B.υ(C)="0.5" mol / (L·s)
C.υ(B)="0.6" mol / (L·s) D.υ(A)="0.15" mol / (L·s)
在反应:C+CO2 2CO中,可使反应速率增大的措施是
2CO中,可使反应速率增大的措施是
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤降低压强
| A.①②③④ | B.②③④⑤ | C.①②③ | D.②③④ |
过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是
| A.升高温度 | B.加入适量的水 | C.加入少量CuSO4溶液 | D.加入浓度较大的盐酸 |
在 A+2B  3C+4D 反应中,表示该反应速率最快的是 ( )
3C+4D 反应中,表示该反应速率最快的是 ( )
A.v(A)=0.3 mol/(L·s) B.v(B)=0.5 mol/(L·s)
C.v(C)=0.8 mol/(L·s) D.v(D)=1 mol/(L·min)
在密闭容器中合成氨反应:N2(g)+3H2(g)  2NH3(g),在下列情况下,不能使反应速度加快的是
2NH3(g),在下列情况下,不能使反应速度加快的是
| A.加入氮气 | B.扩大容器体积,减小压强 |
| C.加入适量催化剂 | D.适当升高温度 |
设C+CO2 =2CO;△H>0,反应速率为v1 ;N2 +3H2 =2NH3 ;△H<0,反应速率为v2 ,对于上述反应,当温度升高时,v1 和v2 的变化情况为
| A.同时增大 | B.同时减小 | C.v1 增大,v2减小 | D.v1 减小,v2 增大 |
2A(g)+B(g)  3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是
A.V(A) = 0.7mol·L-1·min-1 B.V(B) = 0.3mol·L-1·min-1
C.V(C) = 0.9mol·L-1·min-1 D.V(D) = 1.1mol·L-1·min-1
在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应:2A(g)+B(g)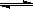 2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是 ( )
2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是 ( )
A.若反应开始时容器体积为2L,则Vc=0.4mol•L-1•min-1
B.若在恒压绝热条件下反应,平衡后nc<<1.6mol
C.若2min后,向容器中再投入等物质的量A、C,B的转化率不变
D.若该反应在恒温恒容下进行,放出热量将增加
一定条件下在固定体积的密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
| A.X、Y、Z的物质的量之比为1∶2∶2 |
| B.X、Y、Z的浓度不再发生变化 |
| C.容器中的压强不再发生变化 |
| D.单位时间内生成n mol Z,同时生成2n mol Y |
足量的锌与酸反应,欲使制取氢气的反应速率尽可能大,选用的反应条件正确的组合是( )
①锌粒 ②锌粉 ③加少量的硫酸银的饱和溶液 ④1mol/L的盐酸⑤5mol/L的硝酸
⑥1mol/L的硫酸 ⑦加热⑧加大量的硫酸铜晶体 ⑨不断振荡 ⑩加大体系的压强
| A.②③⑥⑦⑨ | B.①③⑤⑦⑩ | C.②④⑥⑦⑧⑨ | D.②⑦⑧⑨⑩ |
在一密闭容器中反应2SO2+O2 2SO3经5秒后,SO3的浓度增加了0.4mol·L-1,则在这段时间内用O2表示的反应速率为 mol·L-1·s-1。
2SO3经5秒后,SO3的浓度增加了0.4mol·L-1,则在这段时间内用O2表示的反应速率为 mol·L-1·s-1。
试题篮
()