(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=______________mol/(L·min)
CO2(g)+H2(g);△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=______________mol/(L·min)
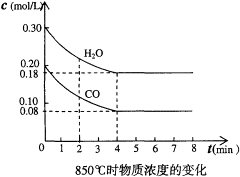
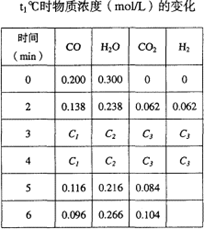
(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右上表。请回答:
①表中3min~4min之间反应处于____________状态;C1数值__________0.08mol/L(填大于、小于或等于)。
②反应在4min~5min问,平衡向逆方向移动,可能的原因是____________(单选),表中5min—6min之间数值发生变化,可能的原因是____________(单选)。
a、增加了水蒸气的量 b、降低温度 c、使用催化剂 d、增加氢气浓度
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3﹣+HSO3﹣→SO42﹣+Cl﹣+H+(未配平).已知该反应的速率随c(H+)的增大而加快.下列为用ClO3﹣在单位时间内物质的量浓度变化表示的该反应V﹣t图.下列说法中不正确的是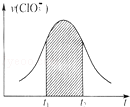
| A.反应开始时速率增大可能是c(H+)所致 |
| B.纵坐标为V(H+)的V﹣t曲线与图中曲线完全重合 |
| C.后期反应速率下降的主要原因是反应物浓度减小 |
| D.图中阴影部分“面积”可以表示t1﹣t2时间为c(Cl﹣)增加 |
向密闭容器中充入物质的量浓度均为 0.1 mol/L的CH4 和 CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是

| A.平衡时CO与H2的物质的量比为1:1 |
| B.p1、p2、p3、p4由大到小的顺序为p1<p2<p3<p4 |
| C.1100℃,p4条件下,该反应10 min时达到平衡点X,则ν(CO2) = 0.008 mol•L-1•min-1 |
| D.随着温度升高,该反应的平衡常数减小 |
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) 4NO2(g)+ O2(g) △H >0
4NO2(g)+ O2(g) △H >0
T1温度下的部分实验数据为
| t/s |
0 |
500 |
1000 |
1500 |
| C(N2O5)mol/L |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法不正确的是
A.500s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1000s时转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1 >T2
D.平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时C(N2O5) >5.00mol/L
在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是
CO(g)+3H2(g)ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是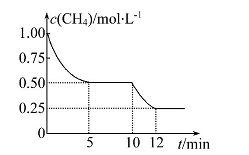
| A.10 min时,改变的外界条件可能是升高温度 |
| B.0~10 min内,v(H2)=0.15 mol·L-1·min-1 |
| C.恒温下,缩小容器体积,一段时间内v(逆)>v(正) |
| D.12 min时,反应达平衡的本质原因是气体总质量不再变化 |
700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2)。
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2)。
| 反应时间/min |
n(CO)/mol |
H2O/mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
下列说法正确的是
A.反应在t1 min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升至800℃,上述反应平衡常数为0. 64,则正反应为吸热反应
向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g) pC(g)+qD(g),已知:平均反应速率vC=
pC(g)+qD(g),已知:平均反应速率vC= vA;反应2 min时,A的物质的量减少了
vA;反应2 min时,A的物质的量减少了 ,B的物质的量减少了
,B的物质的量减少了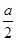 mol,有a mol D生成。回答下列问题:
mol,有a mol D生成。回答下列问题:
(1)反应2 min内,vA=_____mol/(L·min);
(2)化学方程式中,x:y:p:q= ;
(3)反应平衡时,D为2a mol,则B的转化率为________;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1.5 a mol,则该反应的ΔH________0;(填“>”“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率_____,(填“增大”、“减小”或“不变”)理由是 ;
②平衡时反应物的转化率________,(填“增大”、“减小”或“不变”)
理由是 。
恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:
MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:
| 反应时间/min |
n(MgSO4)/mol |
n(CO)/mol |
n(CO2)/ mol |
| 0 |
2.00 |
2.00 |
0 |
| 2 |
|
0.80 |
|
| 4 |
|
|
1.20 |
下列说法正确的是
A.反应在0~2min内的平均速率为v(SO2)=0.6 mol·L-1·min-1
B.反应在2~4min内容器内气体的密度没有变化
C.若升高温度,反应的平衡常数变为1.00,则正反应为放热反应
D.保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是 。
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将 (填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500 s内N2O5的分解速率为 。
③在T2温度下,反应1000 s时测得NO2的浓度为4.98 mol·L-1,则T2 T1(填>、<或=)。
(3)现以H2、O2、熔融Na2CO3组成的燃料电池采用电解法制备N2O5,装置如图所示,其中Y为CO2。

写出石墨Ⅰ电极上发生反应的电极反应式 ,N2O5在电解池的 区生成(填“阳极”或“阴极”)。
一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g) 2NH3(g),反应过程如图:
2NH3(g),反应过程如图: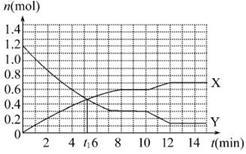
下列说法正确的是
| A.t1 min时正逆反应速率相等 |
| B.X曲线表示NH3的物质的量随时间变化的关系 |
| C.0 min~8 min,H2的平均反应速率v(H2)="0.75" mol·L-1·min-1 |
| D.10 min~12 min,N2的平均反应速率v(N2)="0.25" mol·L-1·min-1 |
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应 X(g)+Y(g)  2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应: 2A(气)+B(气) 2C(气)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1 ② 用物质 B 表示的反应的平均速率为 0. 6 mol·L-1·s-1 ③2 s 时物质 B 的浓度为 0.7 mol·L-1 ④2 s 时物质 A 的转化率为70% 其中正确的是
2C(气)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1 ② 用物质 B 表示的反应的平均速率为 0. 6 mol·L-1·s-1 ③2 s 时物质 B 的浓度为 0.7 mol·L-1 ④2 s 时物质 A 的转化率为70% 其中正确的是
| A.①③ | B.①④ | C.②③ | D.③④ |
下列关于化学反应速率的说法中,正确的是
①用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 ②决定化学反应速率的主要因素是反应物的浓度. ③一定量的锌与过量的稀硫酸反应制取氢气,为减慢反应速率而又不影响生成H2的量,可向其中加入KNO3溶液。④汽车尾气中的NO和CO反应转化为无害的N2和CO2,减小压强,反应速率减慢 ⑤增大压强,一定能加快化学反应速率 ⑥用锌与稀硫酸反应制H2时,滴加几滴硫酸铜溶液能加快反应速率 ⑦使用催化剂,使反应的活化能降低,反应速率加快⑧光是影响某些化学反应速率的外界条件之一 ⑨反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在2 L的密闭容器中进行,1 min后,NH3减少了0.12 mol,则1 min末的化学反应速率为v(NO)=0.06 mol·L-1·min-1
4NO(g)+6H2O(g)在2 L的密闭容器中进行,1 min后,NH3减少了0.12 mol,则1 min末的化学反应速率为v(NO)=0.06 mol·L-1·min-1
| A.①⑤⑥⑨ | B.④⑥⑦⑧ | C.④⑥⑦⑨ | D.③④⑥⑦ |
下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
| A.①是其他条件一定时,反应速率随温度变化的图像,则正反应ΔH>0 |
| B.②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像 |
| C.③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线 |
| D.④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图像 |
试题篮
()