(本题有2小题,共16分,每空2分)
(1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为PbO2+Pb+2H2SO4===2PbSO4+2H2O,据此判断:
①铅蓄电池的负极材料是________。
②工作时,电解质溶液的酸性________(填“增大”、“减小”或“不变”)。
③工作时,电解质溶液中阴离子移向________极。
④电流方向从________极流向________极。
(2)下图表示一定条件下,A、B、C三种气体物质的量浓度随时间变化的情形,回答下列问题:
①该反应的反应物是 。
②该反应的化学方程式为 。
③在0-2min,该反应用A表示的平均反应速率为 。
恒温恒容下,向2 L密闭容器中加入MgSO4(s)和CO(g),发生反应:
MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g)
MgO(s)+CO2(g)+SO2(g)
反应过程中测定的部分数据见下表:
| 反应时间/min |
n(MgSO4)/mol |
n(CO)/mol |
n(SO2) / mol |
| 0 |
2.0 |
2.0 |
0 |
| 2 |
|
0.8 |
|
| 4 |
|
|
1.2 |
| 6 |
|
1.2 |
2.8 |
下列说法正确的是
A.0~2 min内的平均速率为υ(CO)=0.6 mol/(L·min)
B.4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2
C.若升高温度,反应的平衡常数变为1.0,则正反应为放热反应
D.其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)="0.6" mol
t℃时,将3 mol A和1 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)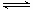 xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为____________;
(2)x=_______;
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母) ________。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)若向原平衡混合物的容器中再充人a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)= ________mol;
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为_________。
下列对图象描述正确的是
| A.图①表示体积和pH值均相同的稀硫酸和醋酸,与足量的镁反应生成H2量的关系 |
| B.图②表示向NaOH溶液中滴加稀盐酸,溶液导电性变化的关系 |
C.图③表示2SO2(g)+O2(g) 2SO3(g)反应过程中,SO2和O2反应速率大小关系 2SO3(g)反应过程中,SO2和O2反应速率大小关系 |
| D.图④表示向氨水中滴加稀硫酸时,溶液的pH大小变化关系 |
铁是当代社会中用量最大的金属之一。磁铁矿是工业上冶炼铁的原料之一,发生的主要反应为:Fe3O4(s)+4CO 3Fe(s)+4CO2
3Fe(s)+4CO2
(1)已知:①Fe3O4(s)+4C(石墨) 3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
②C(石墨)+CO2(g) 2CO(g) ΔH=+172.5 kJ/mol
2CO(g) ΔH=+172.5 kJ/mol
由Fe3O4(s)与CO反应生成Fe(s)的热化学方程式是 。
(2)T℃时,在 2L恒容密闭容器中,加入Fe3O4、CO各1.0 mol ,10 min反应达到平衡时,容器中CO2的浓度是0.4 mol /L。
①能证明该反应达到化学平衡的是 (选填字母)。
a.容器内压强不再变化
b.容器内CO、CO2物质的量比为1 : 1
c.容器内气体的质量不再变化
d.生成CO2的速率与消耗CO的速率相等
②CO的平衡转化率是 。
③l0 min内,反应的平均反应速率v (CO2)= 。
④欲提高该反应中CO的平衡转化率,可采取的措施是 (选填字母)。
a.提高反应温度 b.移出部分CO2
c.加入合适的催化剂 d.减小容器的容积
⑤T℃时,该反应的平衡常数K= 。
把0.6 mol X气体和0.4 mol Y气体混合于2L容器中,发生反应:3X(g) + Y(g) ="==" nZ(g) +2W(g) , 5min末已生成0.2 mol W,若测知以Z浓度变化来表示的平均速率为0.01 mol.L-1.min-1.计算:
(1)n的值为
(2)前5 min内用X表示的反应速率
(3)5 min末Y的浓度
(12分)近年来我国汽车拥有量呈较快增长趋势,NOx是汽车尾气中的主要污染物之一。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①写出该反应的热化学方程式 ,该反应的△S 0(填“>”、“<”或“=”);
②根据下图所示,只改变条件R,当N2的转化率从a3到a1时,平衡常数K 。
| A.可能增大 |
| B.一定不变 |
| C.可能不变 |
| D.可能减小 |
E.增大、减小、不变均有可能
(2)氮气是合成氨的原料之一,合成氨反应:N2(g)+3H2 (g) 2NH3(g) △H<0,500℃时将1molN2与1molH2充入容积为1L的密闭容器中发生反应,达到平衡后NH3的体积分数为20%。若升高温度至800℃,达到新的平衡时,H2的转化率 (填“增大”、“减小”或不变,下同),N2的体积分数 。
2NH3(g) △H<0,500℃时将1molN2与1molH2充入容积为1L的密闭容器中发生反应,达到平衡后NH3的体积分数为20%。若升高温度至800℃,达到新的平衡时,H2的转化率 (填“增大”、“减小”或不变,下同),N2的体积分数 。
(3)在汽车上安装高效催化转化器,将有毒气体转化为无毒气体,可有效降低NOx的排放。某研究性学习小组用气体传感器测得不同时间NO和CO的浓度如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)(×10-4mol·L-1) |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
| c(CO)(×10-3 mol·L-1) |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
请回答下列问题:
①写出反应的化学方程式 。
②前2 s内的平均反应速率ν(N2) = 。
在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)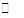 xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求:
(1)x值
(2)B的平衡浓度
(3)A的转化率
(4)用A表示的化学反应速率
【改编】将等物质的量的A、B混合于1L的密闭容器中,发生反应: A(g)+ 3B(g)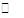 2C(g)+ xD(g),经2min后,测得D的浓度为0.4mol/L,c(A):c(B)=" 5:" 3,C的平均反应速率是0.1 mol/(L·min)。求:
2C(g)+ xD(g),经2min后,测得D的浓度为0.4mol/L,c(A):c(B)=" 5:" 3,C的平均反应速率是0.1 mol/(L·min)。求:
(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值
【原创】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,请回答下列问题: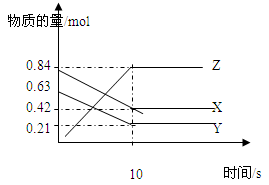
(1)反应的化学方程式。
(2)反应开始到10s,用X表示的反应速率为多少?
(3)Y的平衡转化率。
把在空气中久置的铝片5.0 g投入盛有 500mL0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题:
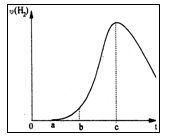
(1)曲线由0→a段不产生氢气的原因___________,有关反应的离子方程式为____________ ;
(2)曲线由a→b段产生氢气的速率较慢的原因___________
有关的化学方程式__________________________;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因_________________________;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因_________________________。
某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得: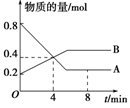
(1)该反应的化学方程式为_________________________________________。
(2)反应开始至4 min时,A的平均反应速率为________________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)=nZ(g)+6W(g)。2 min时生成0.3 mol W,此时测知以Z的浓度变化表示的反应速率为0.05 mol·L-1·min-1。试计算:
(1)前2 min内用X的浓度变化表示的平均反应速率为 mol·L-1·min-1。
(2)计算n值和2 min末时Y的浓度(写出必要的计算过程)。
【改编】将等物质的量的A、B混合于1L的密闭容器中,发生反应:A(g)+ 3B(g) 2C(g)+ xD(g),经2min后,测得D的浓度为0.4mol/L,c(A):c(B)=" 5:" 3,C的平均反应速率是0.1 mol/(L·min)。求:
2C(g)+ xD(g),经2min后,测得D的浓度为0.4mol/L,c(A):c(B)=" 5:" 3,C的平均反应速率是0.1 mol/(L·min)。求:
(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值
在压强为0.1 MPa、10L恒容的密闭容器中,将2 mol CO与 5 mol H2的混合气体在催化剂作用下能生成甲醇:CO(g) + 2H2(g) CH3OH(g) ΔH<0请回答下列问题:
CH3OH(g) ΔH<0请回答下列问题:
(1)①该反应的熵变ΔS 0(填“>”、“<”或“=”)。
②若温度T1 >T2,则平衡常数K(T1) K(T2)(填“大于”、“小于”或“等于”)
③下列措施既可加快反应速率又可增加甲醇产率的是 ;
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入2 mol CO和5 mol H2
④下列可说明反应已达到化学平衡状态的是________;
A.v生成(CH3OH)=v消耗(CO)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.CO与H2浓度比不再变化
(2)若温度T2时,5min后反应达到平衡,CO的转化率为75%,则:
①平衡时体系总的物质的量为 mol;
②反应的平衡常数K= ;
③反应在0-5min区间的平均反应速率v(H2)= 。
试题篮
()