在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |

(1)A点处,v(正)________v(逆),A点正反应速率________B点正反应速率(用“大于”、“小于”或“等于”填空)。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________________。
(3)能说明该反应已经达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
在一体积为10 L的容器中,通过一定量的CO和H2O,850 ℃时发生反应:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
(1)CO和H2O浓度变化如图,则0~4 min的平均反应速率v(CO)=______mol·L-1·min-1。
(2)如图中4~5min之间该反应________(填“是”或“否”)处于平衡状态,判断理由________________________________________________________________________。
某可逆反应从0—2分钟进行过程中, 在不同反应时间各物质的量的变化情况如下图所示。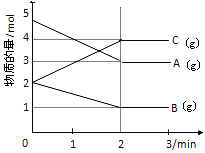
(1)则该反应的化学方程式为 ;
(2)反应开始至2分钟时,能否用C表示反应速率? (填能或不能).若能,其反应速率为 _____ ;若不能,则其原因为 _________ ;
(3)2分钟后A、B、C各物质的量不再随时间的变化而变化,则此时v正(B)与v逆(C)的等量关系是 。
某温度时,在2 L 密闭容器中,X、Y、Z三种物质 的物质的量随时间变化的曲线如下图所示,由图中数据分析:
1)该反应的化学方程式为: ;
(2)反应开始至2 min末,X的反应速率为_____________________________;
(3)该反应是由 开始反应的(填“正反应”、“逆反应”或“正、逆反应同时”)
A与B反应生成C,假定反应由A、B开始,它们的起始浓度均为1 mol.L-1。反应进行2min后,A的浓度为0.8 mol.L-1 ,B的浓度为0.6 mol.L-1 C的浓度为0.6 mol.L-1
(1)2min内反应的平均反应速率为: ν(A)=
(2)ν(A)、ν(B)、ν(C) 三者之间的关系是:
(3)该反应的化学反应方程式:
某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,填空:(4分)
(1)反应开始2min内的平均反应速率 = mol.(L.min)-1,
= mol.(L.min)-1,
(2)容器内的反应物是 。
(3)写出该反应的化学方程式 。
固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是___________。
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |
(3)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线II对应的实验条件改变是___________。
在一定温度下,固定容积的容器内某一反应中M、N的物质的量浓度随反应时间变化的曲线如右图所示:
(1)____________时(填t1、t2或者t3),正、逆反应速率相等,化学反应达到了平衡状态。
(2)计算0到t2时间内N的反应速率是____________。(用t2的式子表示)
(3)该反应的化学方程式为_____________________。
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为____________________;2 min末时Y的浓度为________________;化学方程式中n的值是________。
在2升容器中加入18g水蒸气,28g一氧化碳,在t℃时(t>100),发生如下反应:
CO+H2O CO2+H2,在最初5秒钟内,一氧化碳的平均反应速率是0.02 mol·l-1·s-1求:
CO2+H2,在最初5秒钟内,一氧化碳的平均反应速率是0.02 mol·l-1·s-1求:
(1) 5秒钟末,容器内CO2和H2O蒸汽浓度分别为________,__________。
(2) 若设计此反应为一个原电池,则负极发生________反应(填“氧化”,“还原”),负极消耗的物质化学式为____________。
某温度时,在2L容器中X、Y、Z三种物质随时间的
变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为
(2)反应开始至2min、5minZ的平均反应速率为 、 ;
(3)5min后Z的生成速率比5min末Z的 生成速率 (大、小、相等)。
对于2SO2(g)+O2(g) 2SO3(g) △H<0 反应来说:
2SO3(g) △H<0 反应来说:
(1)若将2mol SO2气体和1mol O2气体在2L容器中混合并在一定条件下发生反应,经2min建立平衡,此时测得SO3浓度为0.8mol·L-1,则从开始至2min用氧气表示的平均速率v(O2)= ;该条件时反应的平衡常数K= 。
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有_________(填字母)。
A.升高温度 B.降低温度 C.增大压强 D.移出生成的SO3
(3)一定温度下,若将8mol SO2气体和4mol O2气体混合置于体积恒定的密闭容器中,能说明该反应已达到平衡状态的是 。
A.SO2的转化率和O2的转化率相等 B.容器内压强保持不变
C.v(SO2)逆 =" 2" v(O2)正 D.容器内密度保持不变
(4)一定温度下,将8mol SO2和4mol O2气体混合置于体积不变的密闭容器中,经t1时间达到平衡,测得混合气体总物质的量为10mol。若此时向容器中充入一定量的氦气,SO3(g)的物质的量将(填“增大”、“减小”或“不变”);若使SO2、O2、SO3三种气体均增加1mol,则平衡______________(填“向左移动”、“向右移动”或“不移动”)。
在某化学反应中,反应混合物A、B、C的物质的量浓度(mol·L—1)与时间t(s)关系如表所示。
| t(s) |
200 |
400 |
800 |
| c(A)(mol·L—1) |
1.45 |
1.28 |
1.00 |
| c(B)(mol·L—1) |
0.38 |
0.72 |
1.28 |
| c(C)(mol·L—1) |
0.095 |
0.18 |
0.32 |
(1)该反应的化学方程式为 。
(2)用A浓度变化表示200~800 s内反应的平均反应速率为 mol/(L·min)。
(3)用C浓度变化表示400~800 s内反应的平均反应速率为 mol/(L·s)。
某温度时,在 一个2 L的密闭容器中,X、Y、Z三种物 质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为 。
(2)从开始至2 min,Z的平均反应速率为 。
试题篮
()